(8分)在2 L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=________。
已知:K300℃>K350℃,则该反应是________热反应。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________________________________________________________________________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(9分)下表是元素周期表的一部分。表中所列的数分别代表某一种化学元素。
| ① |
② |
③ |
|||||||||||||||
| ④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||||||||||||
| ⑨ |
⑩ |
||||||||||||||||
(1)表中①-⑩化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是(用元素符号表示),写出该元素的氧化物与⑨最高价氧化物的水化物反应的离子方程式。
(3)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是(填化学式)。
(4)③、⑦、⑩的氢化物沸点最低的是(填化学式)。③元素与⑩元素两者核电荷数之差是。
(5)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
可供选择的试剂:氯水、溴水、酒精、淀粉、CCl4、NaCl溶液、NaBr溶液。
| 实验步骤 |
实验现象与结论 |
A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,A元素原子的核外电子数、电子层数和最外层电子数均相等,元素B的一种常见单质可做惰性电极材料,C、D、G三种元素在周期表中的相对位置如图①所示,C、D、F的质子数之和等于E、G的质子数之和.E、F为金属元素,只有G元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、C两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质。它们之间的转化关系如图②所示。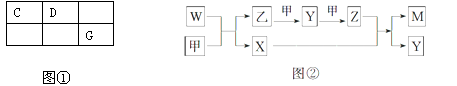
请回答下列问题:
(1)Z的化学式为___________。乙的结构式为。
(2)B的最高价氧化物的电子式为。
(3)用电子式表示A元素和E元素形成化合物的过程:____________________________。
(4)G的单质与水反应的离子方程式的________________________________________。
(5)F的单质与E的最高价氧化物的水化物反应的离子方程式为。
(6)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W空气燃料电池放电时负极反应式为________________________________。
(7分)现有下列物质:①干冰;②氢氧化钠;③过氧化氢;④晶体硅;⑤过氧化钠;⑥醋酸钠;⑦溴化铵;⑧氖;⑨碘晶体;请用编号填写下列空白。
(1)只含极性键的物质有。
(2)只含非极性键的物质有。
(3)只含极性键和非极性键的物质有。
(4)只含离子键和极性键的物质有。
(5)只含离子键和非极性键的物质有。
(6)既含离子键,又含极性键和非极性键的物质有。
(7)不含化学键的物质有。
(9分)(1)周期表前20号元素中,某两种元素的原子序数相差4,周期数相差1,它们形成化合物的原子数之比为1:1。写出这些化合物的化学式。
(2)已知S2Cl2分子内所有原子的最外层均满足8电子结构,写出它的结构式。
(3)碳与它非相邻的短周期元素以极性键形成的化合物中,各原子最外层都达到了8电子稳定结构,写出其中两种化合物的化学式。
(4)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
①据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是和。
②此后,等电子原理又有所发展。例如,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有:、。
(8分)共价键都有键能之说,键能是指拆开1 mol共价键所需要吸收的能量或形成1mol共价键所放出的能量。
(1)已知H—Cl键的键能为431.4 kJ/mol,下列关于键能的叙述正确的是______。
A.每生成1 mol H—Cl键放出431.4 kJ能量
B.每生成1 mol H—Cl键吸收431.4 kJ能量
C.每拆开1 mol H—Cl键放出431.4 kJ能量
D.每拆开1 mol H—Cl键吸收431.4 kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是________。
| 化学键 |
H—H |
H—F |
H—Cl |
H—Br |
| 键能/kJ/mol |
436 |
565 |
431 |
368 |
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是________。
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知:4HCl+O2═2Cl2+2H2O,该反应中,4mol HCl被氧化,放出115.6kJ的热量.断开1mol H﹣O键与断开1mol H﹣Cl键所需能量相差约为kJ.