已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是 ;
(2)B和C的分子式分别是 和 ;C分子的立体结构呈 型,该分子属于 分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是 ,该反应的化学方程式为 ;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是 。
有一工业废水,其中含有少量Fe2+、Ag+、Na+和SO42—。试设计一个实验方案,回收Ag并获得FeSO4·7H2O。请填写下表。
称为“塑料王”的是,制取它的方程式为,该反应的反应类型为。
我国规定饮用水质量标准必须符合下列要求:
| pH |
6.5~8.5 |
| Ca2+、Mg2+ |
<0.004 5 mol·L-1 |
| 细菌总数 |
<100个/mL |
以下是源水处理成自来水的工艺流程示意图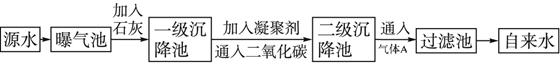
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式:_________________________。
(2)凝聚剂除去悬浮固体颗粒的过程____________(填序号)。FeSO4·7H2O是常用的凝聚剂,它在水中最终生成____________沉淀。
①只是物理过程 ②只是化学过程 ③是物理和化学过程
(3)通入二氧化碳的目的是________________和______________________。
(4)气体A的作用是_________________________。这种作用是基于气体A和水反应的产物具有__________性。
(5)下列物质中____________可以作为气体A的代用品。
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
Ⅰ.如图所示,在大试管里放入一段光亮无锈的弯成螺旋状
的铁丝,把试管倒插入水中,把这个装置这样放置约一周后,观察
到铁丝发生的变化是______________________,原因是
____________________.试管里的水面会上升,最终上升高度约为
________,原因是_________________________________________
________________________________________________________________________.
Ⅱ.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.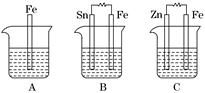
(1)A中反应的离子方程式为__________________________________________.
(2)B中Sn电极的电极反应式为________________________________________,
Sn电极附近溶液的pH__________(填“增大”、“减小”或“不变”).
(3)C中被腐蚀的金属是________,总反应式为________________________.比较
A、B、C中铁被腐蚀的速率,由快到慢的顺序是______________________.
将W g木炭与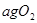 同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为
同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为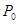 ,高温下容器中木炭与
,高温下容器中木炭与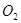 均完全反应后恢复到原温度,压力表的示数为
均完全反应后恢复到原温度,压力表的示数为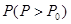 ,试求:
,试求:
(1)当W取值发生变化时,反应后压强P也发生变化,P的最大值(以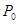 表示)是______。
表示)是______。
(2)以W表示满足题设条件的a的取值范围__________。
(3)在题设条件下,W、a、P、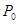 之间必须满足函数系W=f(a、
之间必须满足函数系W=f(a、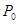 、P),写出该函数表达式:__________________。
、P),写出该函数表达式:__________________。