我国规定饮用水质量标准必须符合下列要求:
| pH |
6.5~8.5 |
| Ca2+、Mg2+ |
<0.004 5 mol·L-1 |
| 细菌总数 |
<100个/mL |
以下是源水处理成自来水的工艺流程示意图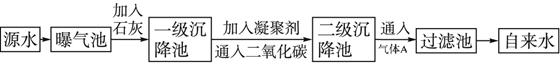
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式:_________________________。
(2)凝聚剂除去悬浮固体颗粒的过程____________(填序号)。FeSO4·7H2O是常用的凝聚剂,它在水中最终生成____________沉淀。
①只是物理过程 ②只是化学过程 ③是物理和化学过程
(3)通入二氧化碳的目的是________________和______________________。
(4)气体A的作用是_________________________。这种作用是基于气体A和水反应的产物具有__________性。
(5)下列物质中____________可以作为气体A的代用品。
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
下列3种有机化合物A:CH2=CH2、 B:CH3COOH、 C:
(1)化合物A、B中的官能团的名称分别是、。
(2)能使溴的四氯化碳溶液褪色反应的化学方程式为:,
该反应类型为:。
(3)能与乙醇发生酯化反应的化学方程式为:。
(4) 在浓硫酸作用下,与浓硝酸反应的化学方程式为:。
在浓硫酸作用下,与浓硝酸反应的化学方程式为:。
有原子序数依次增大的五种短周期元素A、B、C、D、E,已知 A、E同主族,A在所有元素中原子结构最简单,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y;A、B、C、E四种元素都能与D元素分别形成原子个数比不相同的常见化合物,回答下列问题:
(1)B在周期表中的位置是,E的原子结构示意图。
(2)A与C形成化合物中含有的化学键属于(填“极性键”或“非极性键”)。
(3)用电子式表示化合物E2D的形成过程。
(4)C元素的最高价氧化物的水化物与其氢化物反应的离子方程式:。
A、B、C、D是四种有机物,它们的分子中含有两个碳原子,其中A和B是烃。在标准状况下,A对氢气的相对密度是13,B与HCl反应生成C,C与D混合后加入NaOH并加热,可生成B。
(1)写出A、B、C、D的结构简式。A、B、C、D、
(2)写出有关化学方程式:、
。
甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题:
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的棒;乙池中的棒。
②在乙池中阳极的电极反应式是。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中发生总反应的离子方程式。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则溶液混匀后的pH= 。
现有A、B、C、D、E五种易溶于水的强电解质,它们由如下离子组成(各种离子不重复)。
| 阳离子 |
H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 |
OH-、Cl-、HCO3-、NO3-、SO42- |
已知:①0.1 mol/L A溶液的pH <1;②将B溶液分别与其它四种溶液混合,均有白色沉淀生成;
③C溶液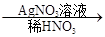 白色沉淀。请回答下列问题:
白色沉淀。请回答下列问题:
(1)写出下列物质的化学式:A______________、B______________。
(2)写出“C溶液 白色沉淀”有关反应的离子方程式____________________________。
白色沉淀”有关反应的离子方程式____________________________。
(3)D、E两种物质中必有一种是_______________,写出将少量该物质的溶液滴加到B溶液中反应的离子方程式___________________________________________________________________。
(4)请你设计实验确定C及另一种未知物各是什么物质。(只许在A~E中选择检验试剂)
| 实验步骤 |
预期现象和结论 |
| 取适量C的溶液于试管中,① 。 |
预期现象和结论1:②; 预期现象和结论2:③; |