某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置(图3)。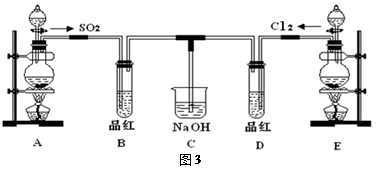
(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:________________________________,D:____________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:________________________________,D:____________________________。
(2)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)______________________________ 。
(3)装置E中用MnO2和浓盐酸反应制得Cl2,若反应生成的Cl2体积为2.24L(标准状况),则被氧化的HCl为 mol。
(4)实验结束后,有同学认为装置C中可能含有SO32-、SO42-、Cl-、OH-等阴离子,请填写检验其中SO42-和SO32-的实验报告。
限选试剂:2 mol·L-1 HCl;1 mol·L-1 H2SO4;l mol·L-1 BaCl2;l mol·L-1MgCl2
1 mol·L-1 HNO3;0.1 mol·L-1 AgNO3;新制饱和氯水。
| 编号 |
实验操作 |
预期现象和结论 |
| 步骤① |
取少量待测液于试管中,滴入 至过量 |
,证明待测液中含SO32-。 |
| 步骤② |
在步骤①的溶液中滴入少量 |
, 证明待测液中含SO42-。 |
(1)将一小粒过氧化钠投入到盛有FeCl2溶液的烧杯中,所观察到的现象是________________________________________________________________________。
所发生反应的离子或化学方程式是:
①______________________________;②______________________________;
③_______________________________。
(2)试设计一个方案,在用廉价的原料和每种原料只用一次的条件下,分三步从含有Fe3+、Cu2+、Cl-、NO3-的废液中,把Fe3+转化为绿矾回收,把Cu2+转化为铜回收,各步反应加入的原料依次是____________、____________、____________。
铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,3 mol FeS2参加反应转移________mol 电子。
6SO2+Fe3O4,3 mol FeS2参加反应转移________mol 电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
________________________________________________________________________。
从腐蚀废液回收得到金属铜还需要的试剂为
________________________________________________________________________。
(3)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是____________________________________________________。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母)。
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
Ⅰ对;Ⅱ对;有 |
| B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁生成铁 |
Ⅰ对;Ⅱ对;无 |
| C |
铁属于过渡元素 |
铁和铁的某些化合物可以用作催化剂 |
Ⅰ错;Ⅱ对;无 |
| D |
铁在空气中表面生成致密氧化膜 |
可用铁罐储存运输浓硫酸、浓硝酸 |
Ⅰ对;Ⅱ对;有 |
某校化学兴趣小组用下图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:
________________________________________________________________________、
(2)氢氧化钠溶液能否用氨水代替,为什么?
________________________________________________________________________
(3)溶液a中存在的离子有 ;在溶液a中加入盐酸时需控制盐酸的量,为什么________________________________________________________________________
为此,改进方法是_____________________________________________________。
A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
根据图示转化关系回答:
(1)写出下列物质的化学式。
A________,B________,乙________,丁________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式
________________________________________________________________________
________________________________________________________________________。
②甲与NaOH溶液反应的离子方程式
________________________________________________________________________
________________________________________________________________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
在50 mL b mol·L-1的AlCl3溶液中加入50 mL a mol·L-1NaOH溶液。
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量为________。
(2)当a、b满足________条件时,无沉淀产生。
(3)当a、b满足________条件时,先有沉淀生成,后又有部分沉淀溶解,此时Al(OH)3的质量为________g。