在铁和氧化铁的混合物15g中加入150mL稀H2SO4放出氢气1.68L(标准状况)。当反应停止后,铁和氧化铁均无剩余,且溶液中无Fe3+存在。为了中和过量H2SO4,并使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol/L NaOH溶液200mL。求:
①混合物中铁和氧化铁各多少克?
②稀H2SO4的物质的量浓度为多少?
要得到100mL浓度为3.68mol/L的稀硫酸溶液,需要98%的浓硫酸(密度为1.84g/mL)的体积多少毫升?
设体积的单位为L。用V体积水制得物质的量浓度为a(密度为p),需要标况下氨气的体积为________________________.
析:
某化合物的化学式可表示为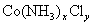 (x、y为正整数)。为了确定x和y的值,取两份质量均为0.2140g的该化合物进行如下两个实验。将一份试样溶于水,在硝酸存在的条件下用
(x、y为正整数)。为了确定x和y的值,取两份质量均为0.2140g的该化合物进行如下两个实验。将一份试样溶于水,在硝酸存在的条件下用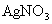 溶液滴定(生成
溶液滴定(生成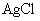 沉淀),共消耗24.0mL 0.100mol/L的
沉淀),共消耗24.0mL 0.100mol/L的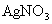 溶液。在另一份试样中加入过量
溶液。在另一份试样中加入过量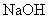 溶液并加热,用足量盐酸吸收逸出的
溶液并加热,用足量盐酸吸收逸出的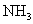 。吸收
。吸收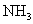 共消耗24.0mL 0.200mol/L
共消耗24.0mL 0.200mol/L 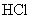 溶液。试通过计算确定该化合物的化学式。(本题可能用到的相对原子质量:H为1.00、N为14.0、Cl为35.5、Co为58.9)
溶液。试通过计算确定该化合物的化学式。(本题可能用到的相对原子质量:H为1.00、N为14.0、Cl为35.5、Co为58.9)
将0.04molKMnO4固体加热,一段时间后,收集到amol气体,此时KMnO4的分解率为x,在反应后的残留固体中加入足量的浓盐酸,又收集到bmol气体(设Mn元素全部以Mn2+存在于溶液中)。试填写:
(1)a+b=__________(用x表示)。
(2)当x=__________时,a+b取最小值,且最小值为___________。
(3)当a+b=0.09时,加热后所得残留固体的质量为___________g。
6.5g Zn在与足量盐酸反应时产生的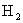 在标准状况下的体积是多少升?
在标准状况下的体积是多少升?