已知H2(g)+Br2(l)=2HBr(g);△H=-72kJ/mol, 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
| H2(g) |
Br2(g) |
HBr(g) |
|
| 1mol分子中的化学键断裂时需要吸收的能量/KJ |
436 |
a |
369 |
则表中a为
A.404 B.260 C.230 D.200
已知下列反应的能量变化示意图如下,有关说法正确的是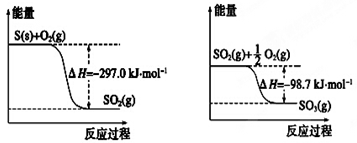
| A.1 mol S(g)与O2(g)完全反应生成SO2(g),反应放出的热量小于297.0 kJ |
| B.在相同条件下,SO2(g)比SO3(g)稳定 |
C.S(s)与O2(g)反应生成SO3(g)的热化学方程式S(s)+ O2(g) O2(g) SO3(g)ΔH=+395.7kJ·mol-1 SO3(g)ΔH=+395.7kJ·mol-1 |
D.一定条件下1 mol SO2(g)和 mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ |
下列事实不能用勒夏特列原理解释的是
| A.氨水应密闭保存 |
| B.光照新制氯水,溶液中的C(H+)增大 |
| C.工业生产硫酸的过程中使用过量氧气以提高SO2的利用率 |
| D.500℃比室温更有利于氨气的合成 |
在恒容密闭容器中A(g)+3B(g) 2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是
2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是
| A.容器中混合气体的平均相对分子质量增大 |
| B.正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| C.正反应速率和逆反应速率都变小,C的百分含量增加 |
| D.混合气体密度的变化情况不可以作为判断反应是否再次达平衡的依据 |
高炉炼铁过程中发生的主要反应为: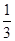 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 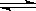
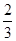 Fe(s)+CO2(g) ΔH < 0 ,欲提高CO的平衡转化率,可采取的措施是
Fe(s)+CO2(g) ΔH < 0 ,欲提高CO的平衡转化率,可采取的措施是
①增加Fe2O3的量②移出部分CO2③提高反应温度④减小容器的容积 ⑤加入合适的催化剂 ⑥降低反应温度
| A.①③ | B.②⑥ | C.②④ | D.④⑥ |