物质A-H有下图所示转化关系(有些产物没有列出)。其中,B是一种极易溶于水的气体,D是能使湿润的淀粉KI试纸变蓝的物质,G是难溶于水的蓝色固体。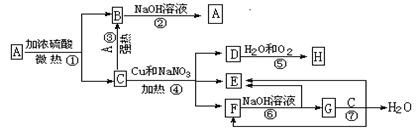
试填写下列空白:
(1)写出Cu与H的浓溶液反应的化学方程式: ;
(2)写出反应④的离子方程式: ;
(3)用电子式表示A和B的形成过程: 、 ;
(4)用惰性电极电解F的水溶液时,两极的电极反应式为:
正极 ;
负极 。
(12分)用化学符号填空:
(1)大理石主要成分中金属元素的符号;
(2)沼气的主要成分;
(3)硫酸钡;
(4)镁离子;
(5)二氧化硫;
(6)氢氧根。
(12分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是________。
(2)根据上述框图反应关系,可推出沉淀C的成分:;
写出沉淀D的一个用途________;写出沉淀B的一个用途________;检验溶液E中阳离子的操作方法(只检验一种即可) 。
(3)写出①、②、③三个反应的化学方程式(属离子反应的写离子方程式)
①______________________________________________________________;
②____________________________________________________________;
③______________________________________________________________;
(8分)钠、铝、铁是三种重要的金属。请回答:
(1)钠元素的金属性比铝的________(填“强”或“弱”)。
(2)将一小块金属钠投入水中,发生反应的离子方程式为 ;可观察到的实验现象是______(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)Fe跟Cl2在一定条件下反应,所得产物的化学式是________。将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成________色。
b.向另一支试管中滴加NaOH溶液,现象为___________________________,
反应的离子方程式是________________________________________________。
用化学用语解释下列事实(其中离子反应必须写离子方程式)
(1)向KAl(SO4)2溶液中滴加Ba(OH)2溶液至生成的沉淀只有一种
(2)除去FeCl2溶液中混有的少量FeCl3
(3)向FeCl2溶液中加入NaOH后的变化
(4)盛放NaOH溶液的试剂瓶必须用胶塞
(5)AlCl3溶液与NaAlO2溶液相遇产生白色沉淀
(6)向Fe(NO3)2溶液中滴加入稀硫酸溶液由浅绿变黄色
化合物G是一种医药中间体,常用于制备抗凝血药。可以通过下图所示的路线合成:
已知:RCOOH RCOCl;D与FeCl3溶液能发生显色。请回答下列问题:
RCOCl;D与FeCl3溶液能发生显色。请回答下列问题:
(1)B→C的转化所加的试剂可能是,C+E→F的反应类型是。
(2)有关G的下列说法正确的是。
| A.属于芳香烃 |
| B.能与FeCl3溶液发生显色反应 |
| C.可以发生水解、加成、氧化、酯化等反应 |
| D.1mol G最多可以跟4mol H2反应 |
(3)E的结构简式为。
(4)F与足量NaOH溶液充分反应的化学方程式为。
(5)写出同时满足下列条件的E的同分异构体的结构简式。
①发生水解反应②与FeCl3溶液能发生显色反应③苯环上有两种不同化学环境的氢原子
(6)已知:酚羟基一般不易直接与羧酸酯化。而苯甲酸苯酚酯( )是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。
)是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。
注:合成路线的书写格式参照如下示例流程图: