下列反应的离子方程式正确的是
| A.铜片插入氯化铁溶液中 Cu+2Fe3+==Cu2++2Fe2+ |
B.电解饱和食盐水 2Cl +2H+ +2H+ H2↑+Cl2↑ H2↑+Cl2↑ |
C.向溴化亚铁溶液中通人过量的氯气 2Fe2++Cl2==2Fe3++2Cl |
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液 NH4++Al3++2SO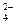 +2Ba2++5OH +2Ba2++5OH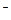 ==AlO ==AlO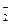 +2BaSO4↓+NH3·H2O+2H2O +2BaSO4↓+NH3·H2O+2H2O |
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5 mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是
| A.反应后溶液中Fe3+物质的量为0.8 mol |
| B.反应后产生13.44 L H2(标准状况) |
| C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol |
| D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
合成氨反应:N2(g)+3H2(g)  2NH3(g) ΔH<0。在反应过程中,逆反应速率的变化如下图所示,下列说法正确的是(B)
2NH3(g) ΔH<0。在反应过程中,逆反应速率的变化如下图所示,下列说法正确的是(B)
A.t1时一定是增加了生成物 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时一定是降低了温度
X、Y、M、Z四种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素。下列说法不正确的是
| A.化合物YZ3极易溶解于水 |
| B.Z与M可以形成含有非极性键的化合物 |
| C.12 g14X中含有中子的物质的量为8 mol |
| D.由上述四种元素组成的离子化合物受热易分解 |
NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是
2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是
| A.v(O2)=0.225 mol·L-1·min-1 | B.v(H2O)=0.375 mol·L-1·min-1 |
| C.v(N2)=0.125 mol·L-1·min-1 | D.v(NH3)=0.250 mol·L-1·min-1 |
已知下列热化学方程式,则③中的Q3值为
Zn(s)+ O2(g)===ZnO (s)△H=" -" Q1 kJ• mol-1①
O2(g)===ZnO (s)△H=" -" Q1 kJ• mol-1①
Hg(l) + O2(g)===HgO (s)△H= -Q2 kJ• mol-1②
O2(g)===HgO (s)△H= -Q2 kJ• mol-1②
Zn(s) +HgO (s) ===Hg(l)+ ZnO (s)△H= -Q3 kJ• mol-1③
| A.Q2 -Q1 | B.Q1 +Q2 | C.Q1- Q2 | D.-Q1- Q2 |