怎样通过实验来区别苯、己烷和己烯?写出简要的实验方法和有关反应的化学方程式。
S2C12是一种金黄色易挥发的液体,具有强烈的窒息性,在工业生产上可用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组进行了以下探究。 【查阅资料】① 干燥的氯气在110℃~140℃与硫反应,即可得到S2C12。② S的熔点为112.8℃、沸点为444.6℃;S2C12的熔点为
【查阅资料】① 干燥的氯气在110℃~140℃与硫反应,即可得到S2C12。② S的熔点为112.8℃、沸点为444.6℃;S2C12的熔点为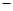 76℃、沸点为138℃。
76℃、沸点为138℃。
③ S2C12+C12 2SCl2。④ S2C12易和水发生反应,生成H2S、SO2、H2SO3、H2SO4等。⑤ClO3-+5Cl-+6H
2SCl2。④ S2C12易和水发生反应,生成H2S、SO2、H2SO3、H2SO4等。⑤ClO3-+5Cl-+6H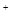 =3C12↑+3H2O请回答下列问题:
=3C12↑+3H2O请回答下列问题: 【实验装置设计】
【实验装置设计】

 (1)B中所放试剂为; C中所放试剂为。
(1)B中所放试剂为; C中所放试剂为。 (2)在加热D时温度不宜过高,其原因是;
(2)在加热D时温度不宜过高,其原因是;
为了提高S2C12的纯度,关键的操作是控制好温度和; (3)G装置的作用是;
(3)G装置的作用是;
(4)写出工业上制漂白粉的化学方程式;
某无色透明溶液可能含有下列离子K+、Al3+、Fe3+、Ba2+、NO3—、SO42—、HCO3—、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________(填代号)。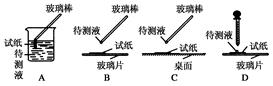
(2)根据上述实验判断原溶液中肯定存在的离子是________,
肯定不存在的离子是________。
(3)写出②实验中产生无色气体的离子方程式:
________________________________________________________________________。
(4)写出③实验中的有关离子方程式:
________________________________________________________________________。
某学生用已知物质的量浓度的盐酸测定未知物质的量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1)配制待测液:用含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制500mL溶液。除烧杯、量筒、胶头滴管和玻璃棒外,还需要的玻璃仪器是。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________。
| A.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
(3)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH 溶液的体积来 |
0.1000mol/L盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.28 |
26.28 |
| 第二次 |
25.00 |
1.55 |
30.30 |
28.75 |
| 第三次 |
25.00 |
0.20 |
26.42 |
26.22 |
依据上表中有效数据计算该NaOH溶液的物质的量浓度:c(NaOH)=__________。(保留四位有效数字)
(4)用标准的盐酸滴定上述待测的NaOH溶液时,眼睛要注视锥形瓶中溶液颜色的变化,直到因加入一滴盐酸后,溶液由黄色变________色,并且___________________为止。
用脱脂棉包住约0.2g过氧化钠固体粉末,置于石棉网上,然后向包有过氧化钠的位置滴加几滴水,结果脱脂棉剧烈燃烧起来。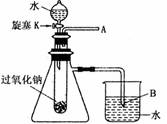
试完成下列问题:
(1)写出过氧化钠与水反应的化学方程式
(2)结合脱脂棉剧烈燃烧的实验事实及燃烧的条件可以得出的结论是
(3)某研究性学习小组,为进一步证明上述结论,拟用如图所示的装置进行有关实验。请写出有关的实验操作方法
现象:A处: B处:
为验证卤素单质氧化性的相对较弱,某小组用下图装置进行实验(夹持仪器已略去,气密性已检验)。实验过程: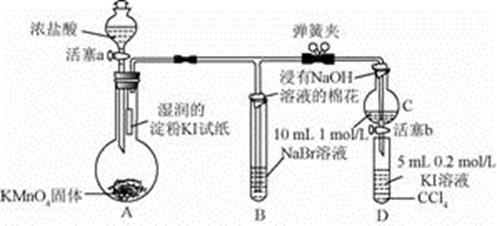
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸,A中产生黄绿色气体。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)D中四氯化碳的电子式是。
(2)验证氯气的氧化性强于碘的实验现象是。
(3)B中溶液发生反应的离子方程式是。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 。
(5)过程Ⅲ实验的目的是。