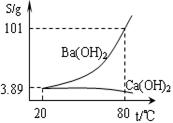
实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(右图为Ba(OH)2和Ca(OH)2的溶解度曲线):







(1)高温灼烧碳酸钡和碳酸钙的混合物,直至分解分解。
所需仪器除坩埚、泥三角、玻璃棒、三脚架外还有
;
(2)将灼烧后的固体混合物置于80℃的热水中,制成氢氧化钡的热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作是 ;
(3)将“⑵”中滤液 并过滤,得到的Ba(OH)2固体溶于水制成溶液。
(4)向制得的Ba(OH)2溶液中滴加 (填一种试剂名称),再通入二氧化碳。当观察到 时,即可停止通二氧化碳。
(5)滤出碳酸钡沉淀,经洗涤、干燥后即得到纯净的碳酸钡。
为测定某有机化合物A的结构,进行如下实验。
[分子式的确定]
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质中各元素的原子个数比是_____________________。
(2)质谱仪测定该有机化合物的相对分子质量为46,则该物质的分子式是 。
(3)根据价键理论,预测A的可能结构并写出其结构简式 。
[结构式的确定]
(4)1H核磁共振谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl—CH2—O—CH3)有两种氢原子(如图1)。经测定,有机物A的1H核磁共振谱示意图如图2所示,则A的结构简式为 。
图1图2
[性质实验]
(5)A在一定条件下脱水可生成B,B可合成塑料C,请写出B转化为C的化学方程式:_______________
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27 ℃)对受伤部位进行局部冷冻麻醉。请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应的化学方程式:_____________
同学们学习了同位素、同素异形体、同系物、同分异构体,下面列出了几组物质,请用物质的组号填写下表。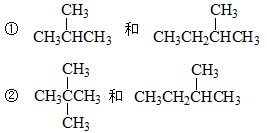
③CH4和CH3CH2CH3 ④金刚石和石墨 ⑤H、D、T⑥16O、17O、18O
⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3) ⑧臭氧(O3)和氧气(O2)
⑨2,2—二甲基丙烷 和 新戊烷⑩CH3CH2OH 和 HOCH2CH3
| 类别 |
同位素 |
同素异形体 |
同分异构体 |
同系物 |
同一种物质 |
| 组号 |
(1)化学与人类生产、生活密切相关。请按要求回答下列问题:
①下列我国古代的技术应用中,其工作原理不涉及化学反应的是 (填字母)
| A.火药使用 |
B.粮食酿酒 |
C.转轮排字 |
D.铁的冶炼 |
 |
 |
 |
 |
②下列用品的有效成分及用途对应错误的是 (填字母)
| A |
B |
C |
D |
|
| 用品 |
 |
 |
 |
 |
| 有效成分 |
NaCl |
NaOH |
NaHCO3 |
Ca(ClO)2 |
| 用途 |
做调味品 |
做治疗胃病的抗酸药 |
做发酵粉 |
做消毒剂 |
③工业上常用氯气和石灰乳反应生产漂白粉,其原理是_________________(用化学方程式表示)。
④在生产中,人们曾用浓氨水来检验氯气管道是否漏气。如果氯气管道某处漏气,用浓氨水检查时就会产生白烟的现象,又知此时发生的是有氮气生成的置换反应,则此时发生反应的化学方程式为____________。
(2)科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究。物质分类及转化思想贯穿整个化学科学习的始终。
①有下列十种物质:
A.空气 B.O2 C.NaHSO4 D.氨水 E.CuSO4·5H2O F.NaOH
G.CO2 H.Fe2O3 I.金刚石 J.H2SO4
其中属于混合物的有 ;属于单质的有 ;属于盐的有 。(填字母)
②有下列六个反应:
A.Cl2+H2O = HCl+HClO
B.Zn + H2SO4 = ZnSO4 + H2↑
C.2Cu2O + Cu2S  6Cu+SO2↑
6Cu+SO2↑
D.Cl2+2KI = 2KCl+I2
E.H2 + Cl2 2HCl
2HCl
F.2KClO3  2KCl+3O2↑
2KCl+3O2↑
其中属于置换反应的是 ,既属于分解反应又属于氧化还原反应的是 (填字母)。
③K2FeO4是一种重要的净水剂,可用下列方法制得:
2Fe(OH)3+3Cl2+10KOH 2K2FeO4+6KCl+8H2O
2K2FeO4+6KCl+8H2O
在该反应中,还原剂是 ,当反应中有1mol K2FeO4生成时,转移电子的数目为 。
(3)物质的量是化学计算的核心。请按要求完成下列填空:
①已知3.01×1023个X气体分子的质量为8g,则X气体的摩尔质量是 。
②含0.4 mol Al3+的Al2O3的质量是 。
③某块光卤石(KCl·MgCl2·6H2O)中含5.3250 g Cl—,则该光卤石的物质的量为 。
④标准状况下,224mL的氨气中含有的氢原子数为 。
Ⅰ.某温度下,向某密闭容器中加入1 mol N2和3 mol H2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m。假设N2、H2、NH3的加入量(单位:mol)用x、y、z表示,应满足:
(1)恒定温度、体积
①若x = 0,y = 0,则z = ;
②x、y、z应满足的一般条件是 。
(2)恒定温度、压强
①若x = 0,y = 0,则z 为 ;
②x、y、z应满足的一般条件是 。
Ⅱ.将2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g)  2H2+O2、2CO+O2
2H2+O2、2CO+O2 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是 和 ,或 和 。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为: n(O2)平=a mol, n(CO2)平=b mol。试求n(H2O)平= 。 (用含a、b的代数式表示)
在T℃下,某Ba(OH)2稀溶液中c(H+)=10-a mol/L,c(OH—)=10-b mol/L,已知a+b=12,向该溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如下表所示:
| 序号 |
氢氧化钡溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
7 |
| ③ |
22.00 |
22.00 |
6 |
(1)依据题意判断,T℃ 25℃(填“大于”、“小于”或“等于”),该温度下水的离子积KW=
(2)x= 原Ba(OH)2稀溶液的物质的浓度为
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2稀溶液时,沉淀正好达到最大值,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为 ,Na2SO4的物质的量浓度为