(1)化学与人类生产、生活密切相关。请按要求回答下列问题:
①下列我国古代的技术应用中,其工作原理不涉及化学反应的是 (填字母)
| A.火药使用 |
B.粮食酿酒 |
C.转轮排字 |
D.铁的冶炼 |
 |
 |
 |
 |
②下列用品的有效成分及用途对应错误的是 (填字母)
| |
A |
B |
C |
D |
| 用品 |
 |
 |
 |
 |
| 有效成分 |
NaCl |
NaOH |
NaHCO3 |
Ca(ClO)2 |
| 用途 |
做调味品 |
做治疗胃病的抗酸药 |
做发酵粉 |
做消毒剂 |
③工业上常用氯气和石灰乳反应生产漂白粉,其原理是_________________(用化学方程式表示)。
④在生产中,人们曾用浓氨水来检验氯气管道是否漏气。如果氯气管道某处漏气,用浓氨水检查时就会产生白烟的现象,又知此时发生的是有氮气生成的置换反应,则此时发生反应的化学方程式为____________。
(2)科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究。物质分类及转化思想贯穿整个化学科学习的始终。
①有下列十种物质:
A.空气 B.O2 C.NaHSO4 D.氨水 E.CuSO4·5H2O F.NaOH
G.CO2 H.Fe2O3 I.金刚石 J.H2SO4
其中属于混合物的有 ;属于单质的有 ;属于盐的有 。(填字母)
②有下列六个反应:
A.Cl2+H2O = HCl+HClO
B.Zn + H2SO4 = ZnSO4 + H2↑
C.2Cu2O + Cu2S  6Cu+SO2↑
6Cu+SO2↑
D.Cl2+2KI = 2KCl+I2
E.H2 + Cl2 2HCl
2HCl
F.2KClO3  2KCl+3O2↑
2KCl+3O2↑
其中属于置换反应的是 ,既属于分解反应又属于氧化还原反应的是 (填字母)。
③K2FeO4是一种重要的净水剂,可用下列方法制得:
2Fe(OH)3+3Cl2+10KOH 2K2FeO4+6KCl+8H2O
2K2FeO4+6KCl+8H2O
在该反应中,还原剂是 ,当反应中有1mol K2FeO4生成时,转移电子的数目为 。
(3)物质的量是化学计算的核心。请按要求完成下列填空:
①已知3.01×1023个X气体分子的质量为8g,则X气体的摩尔质量是 。
②含0.4 mol Al3+的Al2O3的质量是 。
③某块光卤石(KCl·MgCl2·6H2O)中含5.3250 g Cl—,则该光卤石的物质的量为 。
④标准状况下,224mL的氨气中含有的氢原子数为 。
酸性氧化物和碱性氧化物相互作用可生成含氧酸盐,而硫代硫酸盐可由酸性的非金属硫化物与碱性的金属硫化物作用制得。
如:3Na2S+As2S3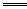 2Na3AsS3(硫代亚砷酸钠),试写出下列反应的化学方程式:
2Na3AsS3(硫代亚砷酸钠),试写出下列反应的化学方程式:
(1)Na2S与As2S5反应: 。
(2)CaS与As2S3反应: 。
(3)As2S3和As2O3相似,具有还原性,Na2S2和Na2O2相似,具有氧化性,则As2S3与Na2S2作用的化学方程式为 。
在通常状况下,NO2和SO2很容易发生反应生成NO和SO3,该反应为不可逆反应。现将NO和SO2的混合气体通入容积为100 mL的容器中,充满后,用带有导管的塞子密封。
(1)向容器中通入O2的体积,x在 数值范围内才能保持容器内的压强不变。
(2)要使容器内只含有NO2和SO3两种气体,必须通入O2 mL。
(3)若向容器中通入40 mL O2后才开始出现红棕色,且不褪色,则原混合气体中NO的体积为 mL(气体体积均在同温、同压下测定,此时SO3为气体,且不考虑2NO2 N2O4的反应)。
N2O4的反应)。
在新疆与青海两省区交界处有一狭长山谷,每当牧民和牲畜进入后,风和日丽的晴天顷刻电闪雷鸣,狂风大作,人畜常遭雷击而倒毙。奇怪的是这里牧草茂盛,四季常青,被当地牧民称为“魔鬼谷”。用化学方程式表示“魔鬼谷”牧草茂盛,四季常青的原因。
A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态。其中D能分别跟A、B、C在一定条件下两两化合,生成化合物X、Y、Z;A与B、C均不能直接化合。有关的转化关系如下图所示(反应条件均已略去)。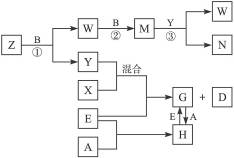
完成下列问题:
(1)Z分子的空间构型为_________。
(2)反应③中被氧化的物质与被还原物质的物质的量之比为_________。
(3)Z和W在催化剂作用下,反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为___________________________。
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023个,则参加反应的E的质量为_________g。
(5)将Z与N反应后的产物溶于水中,则溶液的pH_________(填“<”或“>”)7,其原因是(用离子方程式表示)_________________。
NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体的许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学研究的热点,NO亦被称为“明星分子”。请完成下列问题。
(1)NO对环境的危害在于____________(填以下项目的编号)。
| A.破坏臭氧层 | B.高温下能使一些金属被氧化 |
| C.造成酸雨 | D.与人体血红蛋白结合 |
(2)在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式_____________________________________________________。
(3)在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50 ℃,发现气体的压力迅速下降,压力降至略小于原压力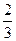 就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式_______________________________________________________。
就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式_______________________________________________________。