利用右图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生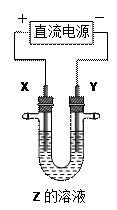
 产。下列说法中正确的是
产。下列说法中正确的是
A.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠 |
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4  |
C.电镀工业中,X是待镀金属,Y是镀层金属 |
D.外加电流的阴极保护法中,Y是待保护金属 |
313 K时,水的KW=3.0×10-14,则在313 K时,c(H+)=10-7 mol/L的溶液()
| A.呈酸性 | B.呈中性 | C.呈碱性 | D.无法判断 |
常温时,下列三种溶液:
①0.001 mol·L-1氨水与0.001 mol·L-1 HCl溶液等体积混合液
②pH=3的HCl与pH=11的NaOH溶液等体积混合液
③pH=11的氨水与pH=3的HCl溶液等体积混合液。
其pH大小关系正确的是()
| A.①=②=③ | B.①>②=③ |
| C.①<②=③ | D.①<②<③ |
对于常温下pH为1的硝酸溶液,下列叙述正确的是()
| A.该溶液1 mL稀释至100 mL后,pH等于3 |
| B.向该溶液中加入pH为13的氢氧化钡溶液恰好完全中和 |
| C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12 |
| D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍 |
下列液体均处于25 ℃,有关叙述正确的是()
| A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| C.25 ℃时,用pH试纸测定出某醋酸溶液的pH=3.50 |
| D.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在:K+、Na+、AlO2-、SO42- |
室温下,水的电离达到平衡:H2O H++OH-。下列叙述正确的是()
H++OH-。下列叙述正确的是()
| A.将水加热,平衡正向移动,KW变小 |
| B.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)增大 |
| C.新制氯水久置后,水的电离平衡正向移动,c(OH-)增大 |
| D.向水中加入少量CH3COONa固体,平衡正向移动,KW增大 |