食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等种类。PVC被广泛地用于食品、蔬菜外包装,它对人体有潜在危害。下列有关叙述不正确的是  A.PVC保鲜膜属于链状聚合物,在高温时易熔化,能溶于酒精
A.PVC保鲜膜属于链状聚合物,在高温时易熔化,能溶于酒精
B.PVC单体可由PE的单体与氯化氢加成制得
C.鉴别PE和PVC,可把其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则是PVC;不变红,则为PE
D.等质量的聚乙烯和乙烯燃烧消耗的氧气相等
在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
| A.800℃下,该反应的化学平衡常数为0.25 |
| B.427℃时该反应的平衡常数为9.4,则该反应的△H<0 |
| C.同温下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7% |
| D.同温下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3% |
某研究小组用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,则下列有关说法错误的是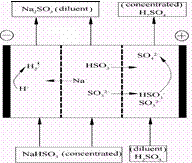
| A.阳极区酸性增强 |
| B.阴极区电极反应式为:2H++2e—=H2↑ |
| C.diluent和concentrated的中文含义为浓缩的、稀释的 |
| D.该过程中的副产品主要为H2SO4 |
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×l0_5 |
4.9×l0_10 |
K1=4.3×l0_7 K2=5.6×l0_11 |
则下列有关说法正确的是
| A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B.a mol·L—1 HCN溶液与b mol·L—1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小 |
| D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-) |
下列离子方程式中正确的是
| A.NaHSO4溶液中加Ba(OH)2溶液至中性: Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| B.NH4HCO3溶液与过量NaOH溶液反应: NH4++OH-=NH3↑+H2O |
| C.高锰酸钾与乙醇制备Mn3O4纳米粉体,同时生成乙醛: 6MnO4—+13CH3CH2OH→2Mn3O4+13CH3CHO+6OH—+10H2O |
| D.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2—+4NH4++2H2O |
质量分数为ω的NaOH溶液,其物质的量浓度为a mol·L-1,加热蒸发水份使其质量分数变为2ω,此时,该溶液中NaOH的物质的量浓度为b mol·L-1,则a与b的关系正确的是
| A.b=2a | B.a=2b | C.b<2a | D.b>2a |