我国著名化学家傅鹰告诫我们“化学给人以知识,化学史给人以智慧。”回顾苯的结构的探索历程,曾有人提出两种立体结构: 就上述两种立体结构回答下列有关问题:
(1) 若苯的结构为(Ⅰ),则在下列项目中它与苯的凯库勒式结构不同的是__________
a.一氯代物种数 b.二氯代物种数
c.与溴水的作用 d.燃烧时烟的浓度
(2) 利用苯的结构(Ⅰ)能解释下列事实的是__________
a.不能使酸性高锰酸钾溶液褪色 b.苯的邻位二氯代物没有同分异构体
c.在一定条件下能和氢气发生加成反应 d.和氯气在一定条件下发生取代反应
(3) 若苯的结构为(Ⅱ),则苯能否使溴水反应褪色?若能,请写出一个可能反应的化学方程式;若认为不能,请说明原因。
(9分) 如图所示,一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)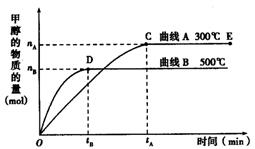
上述可逆反应正反应为___________反应(填“放热”或“吸热”)。
在500℃,从反应开始到平衡,氢气的平均反应速率v(H2) =___________________________(用nB、tB表示)。
对处于E点的体系,改变外界条件使平衡向正反应方向移动时,下列有关该体系的说法正确的是______________________(填字母)。
| A.H2的转化率一定增大 | B.v正一定增大,v逆一定减小 |
| C.CH3OH的质量分数一定增加 | D.v逆一定小于v正 |
CH3OH(g)+H2O(g) CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)在其它条件不变的情况下降低温度,则逆反应速率 (填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率 。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为。
(3)判断该可逆反应达到平衡状态的依据是(填序号)。
| A.v正(CH3OH)=v正(CO2) |
| B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 |
| D.CH3OH、H2O、CO2、H2的浓度都不再发生变化 |
已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
CH4(g) |
| △H/(kJ/mol) |
-283.0 |
-285.8 |
-726.5 |
-890.3 |
请回答下列问题。
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:。
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+ 2H2(g)= CH3OH(l);△H=。
(3)现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:
| A.1∶1 | B.1∶3 | C.1∶4 | D.2∶3 |
氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。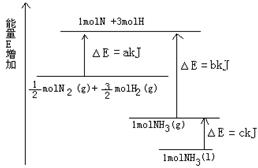
(1)上图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是______________________。
(2).若由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436. 0kJ/mol,则N-H键的键能是________ kJ/mol。
分子式为C2H6O的化合物A具有如下性质:
(1)根据上述信息,对该化合物可作出的判断是。
| A.一定含有—OH | B.一定含有—COOH | C.A为乙醇 | D.A为乙酸(2)含A的体积分数为75%的水溶液可以用作。 |
(3)A与钠反应的化学方程式:。
(4)A可由含淀粉[(C6H10O5)n]的农产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出由淀粉制A的化学方程式:。