A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质存在如图所示转化关系(这些转化关系都不需要使用催化剂)。回答下列问题:

(1)若甲在转化中为还原剂,是常见金属,乙是常见非金属固态单质,且甲、乙、丙都由短周期元素组成,则A的结构式是 ;B的电子式是 ,A与甲反应的化学方程式是
(2)若甲在转化中为氧化剂,是常见非金属气态单质,丙常见金属,甲、乙、丙中只有甲是由短周期元素组成,乙与甲同主族,与丙同周期,乙也有强氧化性,且反应都在溶液中、通常条件下进行,则:
①A与乙反应的离子方程式为:
②C与丙反应的离子方程式为: 。
③当A与甲的物质的量之比为2:3时,A与甲恰好完全反应,且符合上图所示转化关系,则反应的离子方程式为: 。
如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面。下表中对实验现象所做的解释正确的是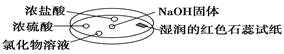
| 选项 |
实验现象 |
解释 |
| A |
浓盐酸附近产生白烟 |
NH3与HCl气体反应生成了NH4Cl固体 |
| B |
浓硫酸附近无明显现象 |
NH3与浓硫酸不发生反应 |
| C |
氯化物溶液变浑浊 |
该溶液一定是AlCl3溶液 |
| D |
湿润的红色石蕊试纸变蓝 |
NH3是一种可溶性碱 |
下列离子方程式正确的是
| A.向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O →CaCO3↓+2HClO |
| B.1mol的Cl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2→2Fe3++4Cl-+I2 |
| C.碳酸氢钙溶液中加入过量的氢氧化钠溶液: HCO3— + OH—→ CO32— +H2O |
| D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-→3Fe3++NO↑+2H2O |
关于如图装置所示的两个实验,说法正确的是
| A.两个装置中都发生了化学变化,都由化学能转变为电能 |
| B.装置②中电流方向是从Zn经导线流入Cu |
| C.反应开始阶段,两个装置中均有氢气产生 |
| D.电极反应式:阳极 2Cl—-2e-→Cl2↑正极 2H++2e-→H2↑ |
NA表示阿伏加德罗常数,下列叙述正确的是
| A.1mol苯乙烯中含有的碳碳双键数为4NA |
| B.6.2g氧化钠晶体中含有0.2NA个Na+ |
| C.标准状况下,22.4L空气含有NA个单质分子 |
| D.1 mol/L NH4Cl溶液中,NH4+的数目小于NA |
下列装置所示的实验不能达到目的的是
| A.装置①定量测定化学反应速率 | B.装置②验证Na和水反应放热 |
| C.装置③比较KMnO4、Cl2、S的氧化性强弱 | D.装置④加热烧杯,分离SiO2和NH4Cl |