2005年江苏酸雨污染有所加重,酸雨发生频率为34.1%,上升了6.2个百分点,每三场雨中就有一场多是酸雨。某校研究性学习小组拟对本市空气中二氧化硫含量(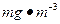 )进行测定。经查阅资料可采用以下方法:
)进行测定。经查阅资料可采用以下方法:
实验原理:大气中的二氧化硫用甲醛溶液吸收后,生成稳定的羟甲基磺酸加成化合物,再加入氢氧化钠使加成化合物分解,释放出二氧化硫,与副玫瑰苯胺、甲醛作用,生成紫红色化合物。据其颜色深浅,用分光光度计在577nm处进行测定。
分光光度计是利用分光光度法对物质进行定量、定性分析的仪器。而分光光度法则是通过测定被测物质在特定波长时光的吸收度,对该物质进行定性和定量分析。其工作原理可以简单地用公式表示为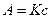 ,其中A为吸光度,K为一定条件下的常数,c为溶液浓度。
,其中A为吸光度,K为一定条件下的常数,c为溶液浓度。
实验步骤:
(1)采样:
①若你是该兴趣小组成员,你对采样的地点和时间有何建议:
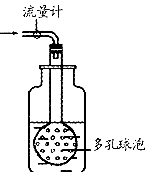
②用图装置采样。通过50L空气后,将吸收液移入100mL容量瓶,用少量吸收液分两次洗涤吸收装置,合并洗涤液于容量瓶中,定容备用。用多孔球泡而不用导管的原因是
(2)吸光度与 含量标准曲线的绘制:在6支25mL比色管中,用每毫升含25
含量标准曲线的绘制:在6支25mL比色管中,用每毫升含25 二氧化硫的标准液配置下表中的标准
二氧化硫的标准液配置下表中的标准 含量系列。
含量系列。
二氧化硫标准系列
| 管号 |
0 |
1 |
2 |
3 |
4 |
b |
| 标准液/mL |
0 |
0.20 |
0.40 |
0.60 |
0.80 |
1.00 |
| 吸收液/mL |
10.00 |
9.80 |
9.60 |
9.40 |
9.20 |
9.00 |
二氧化硫含量/ |
0 |
5.00 |
10.00 |
15.00 |
20.00 |
25.00 |
用10mL比色皿,以水为参比,测定各管吸光度,实验结果如下。
| 管 号 |
0 |
1 |
2 |
3 |
4 |
5 |
| 吸光度 |
0 |
0.20 |
0.40 |
0.60 |
0.80 |
1.00 |
以吸光度值为纵坐标,二氧化硫含量(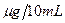 )为横坐标,绘制标准曲线。
)为横坐标,绘制标准曲线。
(3)准确量取容量瓶中溶液10mL加人比色皿,测得其吸光度值为0.24,则空气中二氧化硫含量为 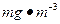 。我国环境空气质量标准中对每次空气质量测定中
。我国环境空气质量标准中对每次空气质量测定中 的最高浓度限值(m9/m3):一级标准:0.15,二级标准:0.50,三级标准:0.70。则该市空气为 级标准。
的最高浓度限值(m9/m3):一级标准:0.15,二级标准:0.50,三级标准:0.70。则该市空气为 级标准。
(4)甲、乙两组同学测定结果相差较大,试分析乙组同学测定空气中 含量偏小的可能原因:(两个所用药品和装置均无问题)
含量偏小的可能原因:(两个所用药品和装置均无问题)
(5)请你提出江苏防治酸雨的两条主要措施:
钠原子与钠离子比较,相同的是
| A.核外电子层数 | B.最外层电子数 |
| C.能与水反应并放出H2 | D.焰色反应 |
下列物质的用途错误的是
| A.硅是制造太阳能电池的常用材料 |
| B.二氧化硅是制造光导纤维的材料 |
| C.水玻璃可用作木材防火剂 |
| D.硅是制取水泥的原料 |
下列实验操作或事故处理正确的是
| A.金属钠着火,立即用水扑灭 |
| B.实验结束后,用嘴吹灭酒精灯 |
| C.皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 |
| D.稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 |
下列各组离子在水溶液中能够大量共存的是
| A.H+、SO42―、SO32― | B.Ba2+、CO32―、N O3― |
| C.Na+、Cl一、SO42― | D.Ca2+、SO42―、K+ |
下列反应属于化合反应的是
A.2Mg+O2 2MgO 2MgO |
B.2Al+Fe2O3 A12O3+2Fe A12O3+2Fe |
C.CaCO3 CaO+CO2↑ CaO+CO2↑ |
D.KCl + Ag NO3 ="=" KNO3+AgCl↓ |