某厂的酸性工业废水中含有一定量的等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。





 填写下面空白。
填写下面空白。
 (1)图中标号处需加入的相应物质分别是①、②、③、④、⑤;
(1)图中标号处需加入的相应物质分别是①、②、③、④、⑤;
 (2)写出①处发生反应的离子方程式;写出③处发生反应的化学方程式;
(2)写出①处发生反应的离子方程式;写出③处发生反应的化学方程式;
 (3)铁红的化学式为;分别写出铁红和氧化铜在工业上的一种主要用途:铁红;氧化铜。
(3)铁红的化学式为;分别写出铁红和氧化铜在工业上的一种主要用途:铁红;氧化铜。
【化学——选修3:物质结构与性质】
碳族元素C、Si、Ge的单质及其化合物在材料、医药等方面有重要的应用。请回答下列问题。
(1)Ge原子核外电子排布式为________________________。
(2)C元素的三种单质的晶体结构如图。
①金刚石晶体中碳原子与碳碳键的个数比为______;石墨晶体中碳原子的杂化类型为__________。
②石墨烯是从石墨材料中剥离出来的、由单层碳原子组成的二维晶体,每个碳原子提供一个p轨道上的电子形成大π键,π电子可以自由移动。将氢气加入到石墨烯中可制得一种新材料石墨烷。下列判断错误的是_______.
A.石墨烯是电的良导体而石墨烷则为绝缘体
B.石墨烯是一种强度很高的材料
C.石墨烯与石墨烷均为高分子化合物
D.石墨烯与H2制得石墨烷的反应属于加成反应
(3)碳元素的电负性比硅元素_______(填“大”或“小”)。CO2分子中碳氧原子之间化学键的成键方式为_________________。
(4)CO可以和很多金属形成配合物,如Ni(CO)4。
①其中Ni与CO之间的键型为_______。Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,则固态Ni(CO)4属于________晶体。
②与配体CO互为等电子体的阴离子有________(任写一种)。NH3也可作为很多配合物的配体。其中N原子的杂化类型为_____________。若配离子[Ni(NH3)6]2-为正八面体结构,则[Ni(CO)2(NH3)4]2+的结构有____________种。
【化学-选修2:化学与技术】镁合金废料回收最常用的是熔炼法,其主要工艺流程为:
废料预处理→熔化→除铁→除气和除渣→铸造。
(1)废料预处理包括粉碎、除油污和油漆。
①粉碎方法有干态机械粉碎法和湿喷机械粉碎法,其中容易造成危险的方法是,理由是。
②把油污和油漆一次性除去最适宜的方法是
A.用热碱洗涤,过滤
B.用有机溶剂溶解,过滤
C.加热气化除去
(2)镁合金在加热到935K时熔化,并不断向其中通入氩气做保护气。若液态镁与空气接触,不但会发生反应产生杂质,而且降低了镁的回收率。写出与空气的两个主要反应方程式、。
(3)向熔融镁中加入固体硼砂(B2O3)除铁,生成FeB2沉渣,写出有关的化学反应方程式。
(4)镁合金除了含有铁之外,还含有少量铝。加入C2Cl6可以除去液态镁中的氢气,还能把铝转化为Al4C3沉渣:
C2Cl6→2C+3Cl2(1)
3C+4Al→Al4C3(2)
①除气除渣炉排出的污染性气体有。
②如果1t镁合金中,铝占3.6‰,则除去铝最少需要加入C2Cl6g。
以甲烷为初始原料制取氢气,是一项比较成熟的技术,下面是制取氢气的流程图,根据信息回答下列问题: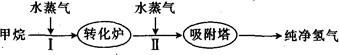
(1)阶段I发生的反应为CH4(g)+H2O(g)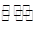 CO(g)+3H2(g)。
CO(g)+3H2(g)。
①已知在“水碳比”[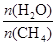 ]等于3时测得温度(T )和压强(p)对上述反应的影响如图所示。则升高温度,该反应的平衡常数K_______(填“增大”、“减小”或“不变”),据图可知p1_________(填“>”、“<”或“=”)p2。
]等于3时测得温度(T )和压强(p)对上述反应的影响如图所示。则升高温度,该反应的平衡常数K_______(填“增大”、“减小”或“不变”),据图可知p1_________(填“>”、“<”或“=”)p2。
②将等物质的量的甲烷和水蒸气充入1L恒容密闭容器中,发生上述反应,某温度下反应达到平衡,平衡常数K=27,此时测得一氧化碳的物质的量为0.10 mol,则甲烷的平衡转化率为____________。
(2)阶段Ⅱ发生的反应为CO(g)+ H2O(g)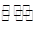 CO2(g)+ H2 (g),T1温度时,向2L的恒容密闭容器中通入一定量的CO和H2O(g),反应过程中测得部分数据如下表所示(表中t1<t2):
CO2(g)+ H2 (g),T1温度时,向2L的恒容密闭容器中通入一定量的CO和H2O(g),反应过程中测得部分数据如下表所示(表中t1<t2):
| 反应时间/min |
n(CO)/mol |
n(H2O)/mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
0.20 |
①保持T1温度不变,若向原容器中通入0.60 rnol CO和1.20 mol H2O(g),则达到平衡后n(CO2)=____。
②若达到平衡后,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是________。
a.CO的转化率将增大
b.H2O(g)的体积分数将增大
c.气体的密度将不变
d.化学平衡常数将增大
e.因混合气体总体积不变,故混合气体的总物质的量不变
(3)储氢问题是安全利用氢能的关键,某合金是一种能够吸收氢气的神奇材料,已知一定条件下1 cm3的该合金最多可吸收6.02×1022个氢原子,液态氢气的密度为0.07 g·cm-3,则相同体积的该合金和液态氢的含氢量之比为_________。
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为。
②反应B+A→C的离子方程式为。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D为(填化学式),此时图b中x 7(填“﹥”“﹤”“﹦”)
②若图c符合事实,则其pH变化的原因是(用离子方程式表示);已知图c中y﹤7,B的焰色反应为黄色,则B溶液中各离子浓度由大到小的顺序是。
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式:。
咖啡酸(见下图),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,特别对内脏的止血效果较好。
(1)咖啡酸的化学式是其中含氧官能团的名称为、。
(2)咖啡酸可以发生的反应是(填写序号)。
①水解反应 ②加成反应 ③酯化反应④消去反应
(3)1mol咖啡酸与浓溴水反应时最多消耗mol Br2。
(4)咖啡酸与NaHCO3溶液反应的方程式。
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇且分子结构中无甲基,此芳香醇的结构简式为,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为。