A、B、C、D、E五种短周期元素,原子序数依次增大,A原子的最外层电子排布式为nsnnpn+1,C、D原子核外都有一个未成对电子,又知B和E为同一主族,C、D、E为同周期,且B、E的原子序数之和等于C、D的原子序数之和
(1) E离子的基态电子排布式 _______________
(2)元素B、C、D、E的原子半径从大到小的顺序是________(用元素符号填写,下同)
(3)元素A、B、C、D的第一电离能从大到小的顺序是
(4)写出C单质与B单质加热时生成的化合物的电子式
(5) D元素在周期表中的位置是_______________,中学化学实验室中制取D的最高价氧化物对应的水化物的离子方程式为___________________________________
(6)已知:①A2(g)+B2(g)=2AB(g) ΔH1=akJ/mol
②2AB(g)+B2(g)=2AB2(g) ΔH2=bkJ/mol
③AB(g)+AB2(g)= A2B3(g) ΔH3=ckJ/mol
则2A2(g)+3B2(g)=2A2B3(g) ΔH= kJ/mol (用a.b.c表示)
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
| 完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
(1)加入过氧化氢的作用是(用离子方程式表示)。
(2)加入碳酸钠调节pH至a得到的滤渣可部分溶于氢氧化钠溶液, a的范围是。
(3)操作Ⅰ包含3个基本实验操作,它们是。
(4)制得的CoCl2·6H2O需减压烘干的原因是。
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合 成甲醇:
成甲醇:
反应Ⅰ: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g) ΔH2
ΔH2
①反应Ⅱ的平衡常数表达式是。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH3=-44.0 kJ/mol
H2O(g) = H2O(l)ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。该电池正极的电极反应为。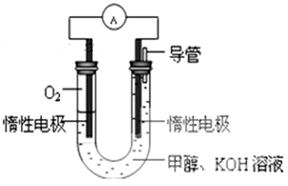
下面是以化合物I为原料合成一种香精(化合物Ⅵ)的合成路线,反应在一定条件下进行。化合物Ⅵ广泛用于香精的调香剂。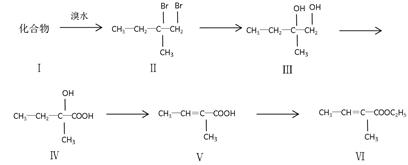
回答下列问题:
(1)化合物Ⅰ生成化合物Ⅱ的反应原子利用率可达100%,化合物Ⅰ的结构简式为。
(2)化合物Ⅲ生成化合物Ⅳ发生反应。
(3)化合物Ⅴ的多种同分异构体中,与化合物Ⅴ官能团种类相同且无支链的共有_____种。
(4)化合物Ⅵ不能发生的反应类型是(填字母)。
| A.加成反应 | B.酯化反应 | C.水解反应 | D.加聚反应 |
(5)写出化合物Ⅵ在一定条件下反应,生成高分子化合物的化学方程式:。
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是。
(3)把KI换成KBr,则CCl4层变为______色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。
(4)加碘盐中含碘量为25.4mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若将Kl与Cl2反应制KIO3,至少需要消耗Cl2L(标准状况,保留2位小数)
在密闭容器中进行如下反应:3m A(g)+m B(g) n C(g)+q D(s)。
n C(g)+q D(s)。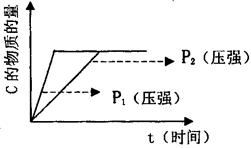
(一)
(1)若在起始容积相等的两个体积可变的容器中,充入物质的量相等的反应物(反应过程中保持体系的温度不变),建立如图所示的平衡,则由图可知:P1P2(填“>”、“<”或“=”);m与n之间的关系为:(用含m的代数式表示n)。
(2)对(1)的反应而言,下列能够判断反应已达化学平衡状态的有。
A.气体总的物质的量不变 B.固体D的物质的量一定
C.气体的密度不变 D.当气体A与B的物质的量之比为3:1时
E.气体A的浓度不变 F.反应速率v (A)=3m/nv(C)
(3)在一定的温度和压强下,将3moIA和1moIB充入体积可变的容器,达到平衡时,B的物质的量浓度为amol/L.现持续增大压强,有:
①当压强为平衡时的2.5倍时,B平衡时的物质的量浓度为C1 mol/L,测得C1=-2.5a;
②当压强为平衡时的10倍时, B平衡时的物质的量浓度为C2mol/L,测得C2= 5.5a;
试分析造成第②种结果的可能原因:。
(二)若m=n=q,且保持原容器的体积不变,在一定温度下,将3molA和1mnolB充入该容器中,平衡时容器中B的转化率为W%。
(4)若在体积和温度不变的条件下,仅从生成物开始配料,要达到上述等数,则D的起始物质的量n(D)应满足的条件是____(用含有W%的代数式表示,下同),平衡时C的转化率为。