甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合 成甲醇:
成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)  ΔH2
ΔH2
①反应Ⅱ的平衡常数表达式是 。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。该电池正极的电极反应为 。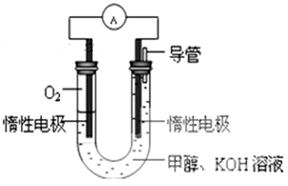
(9分) 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________。
(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中,P元素的化合价为__________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为______(填化学式)。
③NaH2PO2为___________(填“正盐”或“酸式盐”),其溶液显_______(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式_______________________。
(本题共6分)将含O2和CH4的混合气体充入有23.4g Na2O2的密闭容器中,电火花点燃,反应结束后,容器内于150℃时压强约为0,将残留物溶于水,无气体逸出。
(1)原混合气体中O2和CH4体积比为。
(2)残留固体成分。
(本题共14分)某工业废水中可能含有如下几种阴阳离子:
| 阳离子 |
Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 |
Cl-、CO32-、NO3-、SO42-、SiO32- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)已知用铝粉可以除去废水中的一种阴离子(X)。若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)Al + X + OH- =AlO2-+ NH3 + N2 + 。该反应的还原产物是 。若除去0.2mol X离子,要消耗铝 g。
(4)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH至少大于 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
(本题共10分)(一)中学常见单质A、B和甲、乙、丙三种化合物有如图所示的转换关系(部分产物未列出)。单质A常作为食品包装材料,甲是两性氧化物。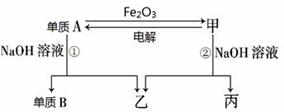
根据图示转化关系回答:
(1)写出下列物质的化学式:单质A_______________,乙_______________。
(2)写出单质A与Fe2O3反应的化学方程式: ,利用该反应的原理,可用于______________________________。
(3)用单质A做成的容器可以储存和运输浓硫酸的原因是____________________________。
(4)写出反应①的离子方程式:_____________________________________________。
(二)(5)工业上冶炼下列物质通常不采用电解法的是 。
a.Na b.Mg c.Fe d.Ag
(6)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有()
a.KCl b. KClO3 c. MnO2 d. Mg
(本题共10分)
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为,若有3molFeS2参加反应,转移mol电子。
(2)与明矾相似,硫酸铁也可用作净水剂,其原理为(用离子方程表示)。
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为。
(4)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请写出相应的离子方程式:。
(5)铁红是一种红色颜料,其成分是Fe2O3将一定量的铁红溶于160mL5mol•L-1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为。