Ⅰ、你见过翩翩起舞的鸡蛋吗?请看以下小实验。(已知白醋浓度比普通食醋浓度大)
甲组:一个鸡蛋、一瓶普通食醋、一个玻璃杯。
乙组:一个鸡蛋、一瓶白醋、一个玻璃杯。
操作:(1)将醋倒入玻璃杯内。(2)把鸡蛋放入杯中。(3)仔细观察,刚开始时鸡蛋沉在水底,可是过了一会儿,鸡蛋周围会出现许多小气泡,这些气泡伴着鸡蛋旋转上升,好像鸡蛋在“跳舞”一样。乙乙组鸡蛋“舞”的比甲组的要剧烈一些。同学们根据以上现象提出了推测:醋酸的浓度越大,鸡蛋“舞”的就越剧烈。于是就换用了冰醋酸(纯净的醋酸)。结果鸡蛋在其中却一点也没有“舞”起来。请回答:
(1)写出鸡蛋周围会出现许多小气泡发生的有关离子方程式
(2)为什么换用了冰醋酸,鸡蛋却一点也没有“舞”起来?
Ⅱ、可用于分离或者提纯物质的方法有:
| A.升华 | B.加热分解 | C.洗气 | D.过滤 |
下列各组混合物的分离或提纯应选用上述哪种方法最合适?(填序号)
(3)除去Ca(OH)2溶液中悬浮的CaCO3颗粒,用 。
(4)除去O2中少量的水蒸气,用 。
(5)除去固体碘中混有的少量NaI,用 。
(6)除去KCl中的KClO3,用 。
硫酸厂用煅烧黄铁矿(FeS2)制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2制备绿矾。
(一)SO2和O2反应制取的反应原理为:2SO2+O2 2SO3,在一密闭容器中一定时间内达到平衡。
2SO3,在一密闭容器中一定时间内达到平衡。
(1)该反应的平衡常数表达式为______。
(2)该反应达到平衡状态的标志是______。
| A.v(SO2)=v(SO3) | B.混合物的平均相对分子质量不变 |
| C.混合气体质量不变 | D.各组分的体积分数不变 |
(二)某科研单位利用原电池原理,用SO2和O2制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
(3)B电极的电极反应式为______;溶液中H+的移动方向由______极到______极;电池总反应式为______。
(三)利用烧渣制绿矾的过程如下
测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL。溶液。
b.量取25 ml。待测液于锥形瓶中。
c.用硫酸酸化的0. 01 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL。根据上述步骤同答下列问题。
(4)滴定时发生反应的离子方程式为(完成并配平离子反应方程式)。
(5)用硫酸酸化的KMnO4滴定终点的标志是
(6)计算上述产品中的FeSO4.7H2O质量分数为______。
能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。
(1)用CO合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
(2)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
①常温常压下已知下列反应的能量变化如下图所示:
由二氧化碳和氢气制备甲醇的热化学方程式为_______。
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2和3molH2,进行上述反应。测得CO2。和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)="_______" ;该温度下的平衡常数数值K=______。能使平衡体系中n(CH3OH)/n(CO2))增大的措施有_______(任写一条)。
(3)工业上利用甲醇制备氢气的常用方法有两种。
①甲醇蒸汽重整法。主要反应为;CH3OH(g)  CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH的平衡转化率为______ 。
CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH的平衡转化率为______ 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH) =0.25时。CH3OH与O2发生的主要反应方程式为______ 。在制备H2:时最好控制n(O2))/n(CH3OH)=______。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
请同答下列问题:
(l)写出向KOH溶液中通入足量Cl2发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为_______。每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为____ mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_______ FeO42-+_______ H2O="_______" Fe(OH)3(胶体)+_______O2↑+_______OH-。
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为________。
(6)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:3Zn(OH)2+2Fe(OH)3+4KOH-----3Zn+2K2FeO4+8H2O,放电时电池的负极反应式为________ 。
钒及化合物用途广泛。工业上常用含少量Al2O3的钒铁矿(FeO×V2O5)碱熔法提取V2O5。简要流程如下:
已知:①焙烧时可发生反应:V2O5 + Al2O3+2Na2CO3 2NaVO3 +2NaAlO2 +2CO2
2NaVO3 +2NaAlO2 +2CO2
②常温下物质的溶解度:NaVO3~21.2 g /100g水;HVO3~0.008 g /100g水
(1)“浸出渣B”的主要成分是。(写化学式)
(2)生产中,不直接用H2SO4浸泡“烧渣A”获取HVO3的原因是。
(3)“操作①”包括、洗涤。如果不洗涤,则产品中可能含有的金属阳离子是、。下列装置(部分夹持仪器省去)可用在实验室进行“操作②”的是。(填序号)



A B C D
(4)NaVO3用于原油的脱硫技术,由V2O5溶于NaOH溶液中制取,反应的离子方程式为。
氯碱工业中电解饱和食盐水的原理示意图如下图所示: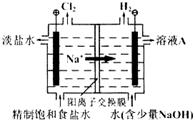
(1)溶液A的溶质是;
(2)电解饱和食盐水的离子方程式是;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42->c(Ca2+)]。精致流程如下(淡盐水和溶液A来自电解池): 
①盐泥a除泥沙外,还含有的物质是。
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有