钒及化合物用途广泛。工业上常用含少量Al2O3的钒铁矿(FeO×V2O5)碱熔法提取V2O5。简要流程如下:
已知:①焙烧时可发生反应:V2O5 + Al2O3+2Na2CO3 2NaVO3 +2NaAlO2 +2CO2
2NaVO3 +2NaAlO2 +2CO2
②常温下物质的溶解度:NaVO3~21.2 g /100g水;HVO3~0.008 g /100g水
(1)“浸出渣B”的主要成分是 。(写化学式)
(2)生产中,不直接用H2SO4浸泡“烧渣A”获取HVO3的原因是 。
(3)“操作①”包括 、洗涤。如果不洗涤,则产品中可能含有的金属阳离子是 、 。下列装置(部分夹持仪器省去)可用在实验室进行“操作②”的是 。(填序号)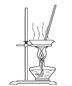



A B C D
(4)NaVO3用于原油的脱硫技术,由V2O5溶于NaOH溶液中制取,反应的离子方程式为 。
已知A 是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。(已知:CH3CH2OH +O2 CH3CHO)
CH3CHO)
请回答下列问题:
(1)写出A的结构简式。
(2)B、C分子中的官能团名称分别是、。
(3)写出与E具有相同官能团的D的同分异构体的结构简式。
(4)写出下列反应的化学方程式:
①;反应类型:。
④;反应类型:。
现有4种有机物:
| A.乙烯, | B.乙醇, | C.乙酸, | D.,.乙酸乙酯。 |
在上述4种有机物中(填写字母,每空只填一个字母):
①能发生水解反应的是。
②具有酸性且能发生酯化反应的是。
③既能发生加成反应,又能发生聚合反应的是。
4 g甲烷在氧气中燃烧生成CO2和液态水,放出222.5 KJ热量,写出甲烷燃烧的热化学方程式
A、B、C三个烧杯中分别盛有物质的量浓度相同的足量稀硫酸。
⑴A中反应的离子方程式为____________________________________________________
⑵B中Fe电极所发生反应的电极反应式为_________________________________,
⑶C中若正极产生112mL气体(标准状况),则负极金属质量减少_____________g。
⑷比较A、B、C中铁被腐蚀的速率由快到慢的顺序是____________________(填字母)。
化学式为C8Hm的烷烃,m值等于;CnH22的烷烃,n值等于;相对分子质量为72的烷烃的分子式为。