在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。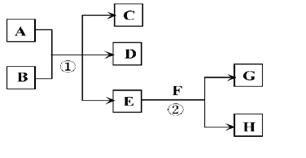
回答下列问题:
(1)写出H的电子式:
(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则反应①的化学方程式是 。
①实验需要检验出C、D、E三种气体产物,三种气体检验的先后顺序是 (用化学式填空),在检验D气体前,需除去C气体,所用试剂是 ,反应的离子方程式是 。
②已知:A(s)+O2(g) =AO2(g) △H=-393.5kJ·mol-1
2A(s)+O2(g) =2AO(g) △H=-221.0kJ·mol-1
则AO的燃烧热的热化学方程式___________________________________.
③AO2在自然界循环时可与碳酸钙反应,碳酸钙是一种难溶物质,它的Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸产生能使品红溶液褪色的气体,在加热条件下,当A过量时,反应①的离子方程式是 。
(4)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是 。
硫酸氢钠(NaHSO4)在水溶液中可以完全电离为Na+和HSO ,HSO
,HSO 在较稀(如1 mol·L-1以下)的溶液中,可完全电离为H+和SO
在较稀(如1 mol·L-1以下)的溶液中,可完全电离为H+和SO 。不过,在浓度大的溶液中HSO
。不过,在浓度大的溶液中HSO 不能完全电离,而是与H+、SO
不能完全电离,而是与H+、SO 共同存在于同一溶液中。
共同存在于同一溶液中。
(1)硫酸氢钠(NaHSO4)所属的物质类别是()
| A.酸 | B.盐 | C.碱 | D.氧化物 |
(2)NaHSO4溶液的pH7。(填“>”“<”或“=”=
(3)在稀NaHSO4溶液中加入Na2CO3溶液时,可以得到无色、无味的气体,该气体可以使澄清石灰水变浑浊。写出稀NaHSO4溶液与Na2CO3溶液反应的化学方程式和离子方程式。
(已知锌与铝具有一定的相似性,如都能在强碱性溶液中形成酸根阴离子。实验室分析白铁(镀锌的铁)样品成分,称取1.00 g样品放在烧杯中,加入过量盐酸,然后用玻璃片盖住烧杯,首先观察到有大量气体冒出,后来放出气体速率变慢,至不再放出气体。接着加入过量的NaOH溶液,过滤分离出灰绿色沉淀,该沉淀在空气中加强热至质量不变,最后得到1.20 g红色粉末。
(1)白铁镀锌的作用是______________;盖玻璃片的作用是____________。
(2)放出气体速率由快变慢的原因是_______________________________________。
(3)为什么要加入过量NaOH溶液__________________________________________。
(4)样品中锌的质量分数是_______________________________________________。
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去。常温下,G为固体单质,B、I为液体,其余都为气体。A为化合物,I的浓溶液与G在加热条件下生成F、B和C。H可用作工业上冶炼金属的还原剂。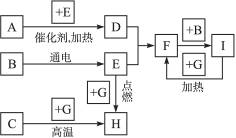
请按要求填空:
(1)写出下列物质的化学式:A______________,B____________,C____________。
(2)写出A→D的化学方程式________________________。
(3)写出G和I的浓溶液反应的化学方程式:________________________。
某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、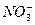 、
、 、
、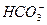 、Cl-等,取该溶液进行如下实验:
、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________________(填代号)。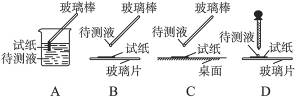
(2)根据上述实验判断原溶液中肯定存在的离子是______________________,肯定不存在的离子是___________________。
(3)写出与②和③两个实验有关的离子方程式:
②____________________________________________,
③____________________________________________。
(1)在浓硝酸中放入铜片。
①开始反应的化学方程式为__________________________________。
②若铜有剩余,则反应将要结束时的反应方程式是______________________________。
③等反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是
_______________________________________________________________________________。
(2)在100 mL混合酸中,c(HNO3)="0.4" mol·L-1,c(H2SO4)="0.2" mol·L-1,向其中加入2.56 g铜粉,微热,等充分反应后,溶液中Cu2+的物质的量浓度为__________________________。
(3)14 g铜银合金与一定量某浓度的硝酸溶液反应,将放出的气体与1.12 L(标准状况下)氧气混合通入水中,恰好全部被水吸收,则合金中铜的质量是_________________g。