将与“实验操作”相对应的“实验现象”的字母代号填入“答案”栏中。
| 实验操作 |
答案 |
实验现象 |
| (1)将浓硫酸滴在小木条上 |
|
A.产生白烟 |
| (2)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近 |
|
B.产生蓝色物质 |
| (3)在盛有KI淀粉溶液的试管中滴加氯水 |
|
C.溶液呈红色 |
| (4)在盛有FeC13溶液的试管中滴入2滴KSCN溶液 |
|
D.变黑色 |
Ⅰ.有机物A的结构简式为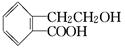 ,它可通过不同化学反应分别制得B、C和D三种物质。
,它可通过不同化学反应分别制得B、C和D三种物质。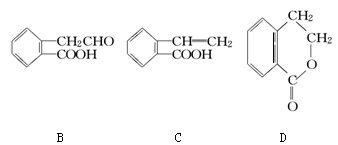
(1)B中含氧官能团的名称是________。
(2)A →C的反应类型是________;A~D中互为同分异构体的是________。
(3)由A生成B的化学方程式是______________________________________。
Ⅱ.某芳香族化合物H常用作防腐剂,H可利用下列路线合成:
已知:①A是相对分子质量为92的烃;
②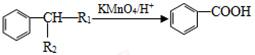
③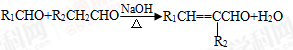 (-R1、-R2表示氢原子或烃基);
(-R1、-R2表示氢原子或烃基);
④D的核磁共振氢谱表明其有两种不同化学环境的氢(两种不同位置的氢原子),且峰面积之比为1:1。
回答下列问题:
(1)A的分子式为___________。
(2)同时符合下列条件的E的同分异构体共有____________种。
①分子中含有苯环
②能发生银镜反应
③能与FeCl3溶液发生显色反应
(3)检验F中含氧官能团的试剂为____________(填试剂名称),由F→G的反应类型为______。
(4)H的结构简式为_____________________________________。
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。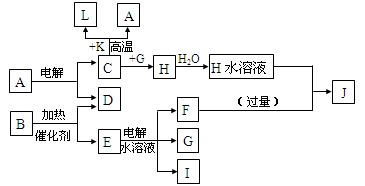
请回答:
(1)工业上制C用A不用H的原因。
(2)写出C与K反应的化学方程式,该反应的反应物总能量(填“大于”或“小于”)生成物总能量。
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式。
(4)写出E物质的电子式。
(5)J与H反应的离子方程式为。
(6)写出G与熟石灰反应制取漂白粉的化学方程式。
(本题12分)某化学科研小组研究在其他条件不变时,改变某一反应条件对反应[可用aA(g)+bB(g)  cC(g)表示]化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):
cC(g)表示]化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):
(1)在反应Ⅰ中,若p1>p2,则此正反应为(填“吸热”或“放热”)反应,也是一个气体分子数(填“减小”或“增大”)的反应。由此判断,此反应自发进行必须满足的条件是。
(2)在反应Ⅱ中,T1T2(填“>”、“<”或“=”),该正反应为(填“吸热”或“放热”)反应。
(3)在反应Ⅲ中,若T2>T1,则此正反应为(填“吸热”或“放热”)反应。
(4)反应Ⅳ中,若T1>T2,则该反应能否自发进行?。
(本题10分)工业合成氨N2+3H2 2NH3反应过程中的能量变化如图所示,据图回答下列问题:
2NH3反应过程中的能量变化如图所示,据图回答下列问题:
(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点升高还是降低,理由是。
(2)该反应的平衡常数表达式为:K=,当浓度商QcK(填“<”、“>”或“=”)时,反应向右进行。
(3)450 ℃时该反应的平衡常数500 ℃时的平衡常数(填“<”、“>”或“=”)。
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有(填字母序号)。
a.高温高压
b.加入催化剂
c.增加N2的浓度
d.增加H2的浓度
e.分离出NH3
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题:
(1)元素D在周期表中的位置_______________________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)___________.
(3)由A、B、C三种元素以原子个数比4 :2 :3形成化合物X,X中所含化学键类型有______________.
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:____________;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方________________。