应用化学反应需要研究化学反应的条件、限度和速率。
(1)773 K、固定体积的容器中,反应CO(g)+2H2(g)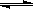 CH3OH(g)过程中
CH3OH(g)过程中
能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amol H2,平衡时能生成0.1amol CH3OH,反应就具工业应用价值。
① 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ;
② ②在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③ ③下列与催化剂有关的说法中,正确的是 (填字母序号)。
④ a.使用催化剂,使反应 CO(g)+2H2(g)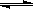 CH3OH(g) ΔH>-91 kJ·mol-1
CH3OH(g) ΔH>-91 kJ·mol-1
⑤ b.使用催化剂,能够提高反应物转化率
c.使用催化剂,不能改变反应的平衡常数K
(2)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如下图I所示。
①Fe电极作 极(填“阴”或“阳”);
②Ni电极的电极反应式为: 。
(3)欲用下图II装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定
推算反应速率。
下图是中学中常见的五种物质及其转化关系: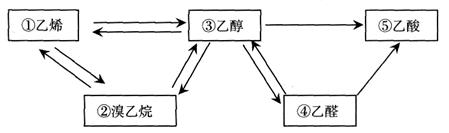
(1)上述物质中属于烃类的有(填序号)。
(2)能和碳酸氢钠反应的物质是(填序号)。反应的方程式为。
(3)实验室制取乙烯的原料是(填序号),该反应的化学方程式为,反应类型是。
(4)乙烯可用于生成聚乙烯,聚乙烯的结构简式为。其制成的塑料可以反复加热熔融加工,属于塑料(填“热塑性”或“热固性”)。
(5)写出溴乙烷发生消去反应的方程式。
现有下列物质:①乙炔②苯酚溶液③乙醛④淀粉溶液⑤氨基酸。请回答:
(1)遇碘水呈蓝色的是(填序号,下同)。
(2)能发生成肽反应的是。
(3)能跟溴发生加成反应的是。
(4)能跟银氨溶液发生银镜反应的是。
(5)能跟饱和溴水反应生成白色沉淀的是。
常温下,两种溶液:①0.1 mol/L HAC②0.1 mol/L NaAC。
(1)溶液①的pH7(填“>”、“<”或“=”),溶液中离子的电荷守恒的关系式是。
(2)溶液②呈性(填“酸”、“碱”或“中”)。其原因是(用离子方程式表示)。
(3)两种溶液中c(AC-)的大小为(填序号)。
a. 两种溶液中c(AC-)都等于0.1 mol/L
b. 两种溶液中c(AC-)都小于0.1 mol/L
c. HAC溶液中c(AC-)小于NaAC溶液中c(AC-)
(4)若将①②两溶液按一定的量混合,混合后溶液显中性,则①②两溶液的体积关系是:①②(填“=”或“>”或“<”)
某小组同学在实验室中组装如下图所示装置,a为铁片,b为石墨,请回答: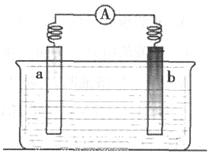
(1)从能量转化的角度看,该装置是将(填能量转化的形式),符合该装置的化学反应类型一定是反应。
(2)若容器内盛有H2SO4溶液,则b极的电极反应式是,b极附近观察到的现象是;导线中电子流动的方向是(用“a→b”或“b→a”表示)。
(3)若容器内盛有NaCl溶液,则a为极(填电极名称);b极的电极反应式是。溶液中的阳离子向(填“a”或“b”)极方向移动。
煤炭可以转化为清洁能源和化工原料。
(1)用煤可以制得水煤气。工业上可用煤和水通过水煤气法制氢气,已知下列热化学方程式:
C(s)+ O2(g)=CO(g)
O2(g)=CO(g)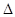 H1=-110.5 kJ/mol
H1=-110.5 kJ/mol
2H2(g)+O2(g)=2H2O(g)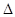 H2=-483.6 kJ/mol
H2=-483.6 kJ/mol
试求水煤气法制氢气的反应的反应热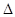 H3。
H3。
C(s)+H2O(g)=CO(g)+H2(g)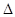 H3=kJ/mol
H3=kJ/mol
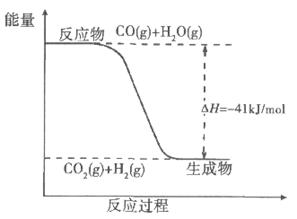
(2)已知一氧化碳与水蒸气反应过程的能量变化如下图所示:则此反应为(填“吸热”或“放热”)反应,反应的热化学方程式为。