浓度为0.50mol·L-1的某金属阳离子Mn+的溶液10.00mL,与0.40mol·L-1的NaOH溶液12.50mL完全反应,生成沉淀,则n等于



| A.1 | B.2 | C.3 | D.4 |
(届江苏省南通市高三第二次调研化学试卷)
常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如右图所示。下列说法正确的是
| A.当V=0时:c(H+)+c(HCO 3-)+c(H2CO3)=c(OH-) |
| B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-) |
| C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3) |
| D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
(届江西省八校高三下学期联考理综化学试卷)
下列叙述或表示正确的是
| A.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1=b |
| B.常温下0.1 mol·L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)="0.1" mol·L-1 |
| C.难溶电解质AB2的饱和溶液中,c(A2+)=xmol·L-1, c(B-)="y" mol·L-1,则Ksp值为4xy2 |
| D.用200mL4 mol·L-1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O |
(2014届江西省九江市七校高三第二次联考化学试卷)
下列溶液中有关物质的浓度关系正确的是()
| A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)> c[(NH4)2SO4]> c(NH4Cl) |
| B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.1.0 mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
(届山东省日照市高三3月模拟考试理综化学试卷)
25oC时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
| A.曲线I中滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线I中滴加溶液到25 mL时:c(NH4+)>c(C1-)>c(H+)>c(OH-) |
| C.曲线II中滴加溶液在10 mL~25 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D.曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
(2014届天津市十二区县重点校高三第一次模拟考试理综化学试卷)
室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合溶液的pH=5,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出的c(H+) =1×10-5 mol/L
B.c(A-) + c(HA) ="2c" (Na+) = 0.4 mol/L
C.HA溶液中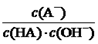 与上述混合溶液中
与上述混合溶液中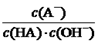 相等
相等
D.c(A-)-c(HA) =" 2" c (OH-)-2c (H+)