研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
 ①SO2+N2O5
①SO2+N2O5 SO3+NO ②SO3+H2O
SO3+NO ②SO3+H2O H2SO4 ③2NO+O2
H2SO4 ③2NO+O2 2NO2
2NO2
 NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是( )
NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是( )

A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 |
B.硫化氢通入浓H2SO4 |
C.浓H2SO4滴入萤石中,加热 |
D.加入少量的H2SO4使乙酸乙酯水解 |
在外界提供相同电量的条件下,Cu2+或Ag+分别按Cu2++2e-="Cu" 或Ag++e-=Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为()
| A.12.96g | B.3.24g | C.6.48g | D.1.62g |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是()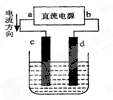
| A.a为阳极、b为阴极 | B.a为负极、b为正极 |
| C.电解过程中,氯离子浓度不变 | D.电解过程中,d电极质量增加 |
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是( )
①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
| A.①③④⑤ | B.①②④⑤ | C.①②③④ | D.①②④ |
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是()
| A.金刚石与石墨互为同位素 |
| B.石墨不如金刚石稳定 |
| C.金刚石与石墨互为同分异构体 |
| D.等质量的石墨与金刚石完全燃烧,金刚石放出的能量多 |
下列变化中生成物的总能量大于反应物的总能量的是( )
| A.H + H = H—H | B.H—Cl =" H" + Cl |
| C.Mg + 2HCl = MgCl2 + H2 ↑ | D.H2SO4 + 2NaOH = Na2SO4 + 2H2O |