下列有机物在酸性催化条件下发生水解反应,生成两种不同的有机物,且这两种有机物的相对分子质量相等,该有机物是
| A.蔗糖 | B.麦芽糖 | C.乙酸丙酯 | D.丙酸乙酯 |
如图所示,Ⓐ为直流电源,Ⓑ为浸透饱和氯化钠溶液和酚酞试液的滤纸,Ⓒ为电镀槽。接通电路(未闭合K)后发现Ⓑ上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是 ( )。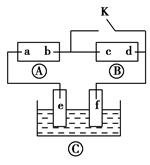
| A.b为直流电源的负极 |
| B.f极为阴极,发生还原反应 |
| C.e极材料为铁片,f极材料为铜片 |
| D.可选用CuSO4溶液或CuCl2溶液作电镀液 |
工业上可用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn,其工艺流程如下: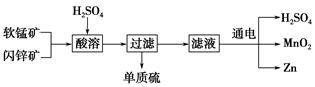
下列说法正确的是 ( )。
| A.酸溶时,MnO2作还原剂 |
| B.可用盐酸代替硫酸进行酸溶 |
| C.原料硫酸可以循环使用 |
| D.在电解池的阴极处产生MnO2 |
甲醇燃料电池被认为是21世纪电动汽车的最佳候选动力源,其工作原理如图所示。下列有关叙述正确的是( )。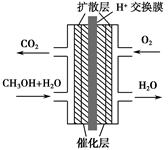
| A.通氧气的一极为负极 |
| B.H+从正极区通过交换膜移向负极区 |
| C.通甲醇的一极的电极反应式为CH3OH+H2O-6e-=CO2↑+6H+ |
| D.甲醇在正极发生反应,电子经过外电路流向负极 |
下列有关物质浓度关系的描述,正确的是 ( )。
| A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1 |
| B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42—)>c(OH-)=c(H+) |
| C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c(CO32—)=c(H+)+c(H2CO3) |
| D.同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3) |
25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )。
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)≈10-5 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
D.HY与HZ混合,达到平衡时c(H+)= +c(Z-)+c(OH-) +c(Z-)+c(OH-) |