将一定量的和含0.7氧气的空气(忽略)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应: (正反应放热)。反应达到平衡后,将容器中的混合气体通过过量溶液,气体体积减少了21.28;再将剩余气体通过焦性没食子酸的碱性溶液吸收,气体的体积又减少了5.6(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量溶液,气体体积减少了21.28;再将剩余气体通过焦性没食子酸的碱性溶液吸收,气体的体积又减少了5.6(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
 请回答下列问题:
请回答下列问题:



 (1)判断该反应达到平衡状态的标志是。(填字母)
(1)判断该反应达到平衡状态的标志是。(填字母)
 a.和浓度相等 b.百分含量保持不变
a.和浓度相等 b.百分含量保持不变
 c.容器中气体的压强不变 d.的生成速率与的消耗速率相等
c.容器中气体的压强不变 d.的生成速率与的消耗速率相等
 e.容器中混合气体的密度保持不变
e.容器中混合气体的密度保持不变
 (2)欲提高的转化率,下列措施可行的是(填字母)
(2)欲提高的转化率,下列措施可行的是(填字母)
 a.向装置中再充入 b.向装置中再充入
a.向装置中再充入 b.向装置中再充入
c.改变反应的催化剂 d.生高温度
 (3)求该反应达到平衡时的转化率(用百分数表示)。
(3)求该反应达到平衡时的转化率(用百分数表示)。
 (4)若将平衡混合气体的5%通入过量的溶液,生成沉淀多少克?
(4)若将平衡混合气体的5%通入过量的溶液,生成沉淀多少克?
最近国外研究出一种高效的水果长期保鲜新技术:在3℃潮湿条件下的水果保鲜室中用一种特制的低压水银灯照射,引起光化学反应,使水果贮存过程中缓缓释放的催熟剂转化为没有催熟作用的有机物。试回答:
(1)可能较长期保鲜的主要原因是__________________________________________。
(2)写出主要反应的化学方程式___________________________________________。
下列烷烃的命名是否正确?若有错误加以改正,把正确的名称填在横线上: (1)CH3—CH—CH2—CH3 2—乙基丁烷
(1)CH3—CH—CH2—CH3 2—乙基丁烷 CH2
CH2
CH3
 (2)CH3—CH—CH—CH3 3,4—二甲基戊烷
(2)CH3—CH—CH—CH3 3,4—二甲基戊烷 CH3 CH2
CH3 CH2
CH3
 CH3—CH2—CH2CH2—CH3
CH3—CH2—CH2CH2—CH3
 (3)CH3—CH2—C—CH—CH—CH3 5—甲基—4,6三乙基庚烷
(3)CH3—CH2—C—CH—CH—CH3 5—甲基—4,6三乙基庚烷 CH2 CH3
CH2 CH3
CH3
用金属钠制取 通常采用下法:
通常采用下法: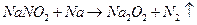 ,试说明不采用钠在氧气中燃烧而用此法制取
,试说明不采用钠在氧气中燃烧而用此法制取 的原因:
的原因:
试样x由氧化亚铁和氧化铜组成.取质量相等的两份试样,按下图所示进行实验.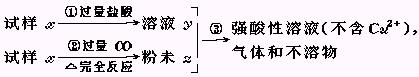
(1)请写出步骤③中所发生的全部反应的离子方程式.
(2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为 (用m表示).
在三个密闭容器内分别装有:A.Na2O2和NaHCO3,B.Na2O2和NH4HCO3,C.Na2O2和Ca(HCO3)2,其中每种物质均为1 mol。将它们加热至300℃,经充分反应后排出气体,写出各容器内残留的固体物质名称及其物质的量。A ,B ,C ,如分别加入相同浓度的足量稀H2SO4与残留物完全反应,则消耗硫酸的体积从大到小的顺序依次为 。