臭氧(O3)是一种有点腥气味的淡蓝色气体,它具有比氧气更强的氧化性。臭氧能使湿润的淀粉碘化钾试纸变蓝,反应中有氧气产生,这个反应的化学方程式是: ,这个反应的氧化产物是 ,还原产物是 。
将气体A、B置于容积为2L的密闭容器中,发生如下反应:3A(g) +B(g) 2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6 mol,C的物质的量为0.4 mol,则:①用C表示该反应的速率为:;
2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6 mol,C的物质的量为0.4 mol,则:①用C表示该反应的速率为:;
②用A表示的速率为:;
③反应前A的物质的量浓度是:;
④10s末,D的浓度为:;
在35 Cl中含有个电子,个中子,氯在周期表中位置,
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为___________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为______(填元素符号),其原因是____________。
(3)B2A4是石油炼制的重要产物之一 。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为__________。氧元素与氟元素能形成OF2分子,该分子的空间构型为__________。
(2)根据等电子体原理,在NO2+中氮原子轨道杂化类型是__________;1 mol O22+中含有的π键数目为__________个。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为__________。
(4)下列物质的分子与O3分子的结构最相似的是__________。
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(5)O3分子是否为极性分子?__________。
下表中实线是元素周期表的部分边界,其中上边界并未用实线画出。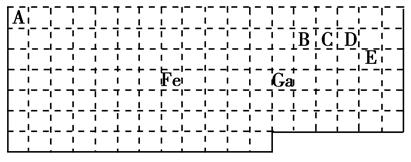
根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为________________________________________________。
(2)铁元素位于元素周期表的__________区;Fe和CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________。
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO互为等电子体的分子和离子分别为__________和__________(填化学式)。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有__________。
(5)根据VSEPR模型预测ED4-的空间构型为__________。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为__________(写3种)。