有一定质量的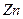 与
与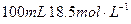 的浓
的浓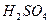 充分反应,
充分反应,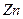 完全溶解,同时生成标准状况下的气体A33.6L,将反应后的溶液稀释到1L,测得溶液中
完全溶解,同时生成标准状况下的气体A33.6L,将反应后的溶液稀释到1L,测得溶液中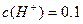

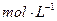 。则气体A中各组分的体积比为
。则气体A中各组分的体积比为 
(1)肥皂是家庭日常用品,通常用油脂与强碱通过反应来获得,试写出硬脂酸甘油酯制肥皂的化学方程式:。
(2)肥皂和洗涤剂能够去掉油污,是由于它们的分子里有非极性的烃基是水基,另一部分极性的酸基盐是水基,前者插入油污,后者插入水中,经摩擦、振动去污。
目前部分汽车已经使用乙醇汽油。其中乙醇可以由含淀粉的农产品如玉米等发酵、蒸馏而得。
(1)完成下列化学方程式:
淀粉+水 葡萄糖:___________________________________
葡萄糖:___________________________________
葡萄糖 乙醇:____________________________________。
乙醇:____________________________________。
(2)已知在盛有葡萄糖溶液的某容器中加入酵母菌,不久溶液中所含180 g葡萄糖全部消耗完。将此过程中产生的所有CO2气体用导管导入足量的澄清石灰水中,共析出白色沉淀400 g,此过程中产生的酒精总量为________ g。
(3)车用乙醇汽油称为环保燃料的原因是________________________________________
①某食堂的午餐食谱为:米饭、馒头、烧鱼、烧排骨,该食谱中还应增加的配菜是;米饭、馒头的主要成分的化学式为;鉴别稀蛋白质溶液和稀淀粉溶液这两种无色液体,可使用的试剂是。
②在氢氧化铝、碳酸钙、青霉素这三种常见的药物中,能用于抗菌消炎的是;
2011年5月,台湾传出“毒饮料事件”,一些厂商在饮料中违法添加了“塑化剂”,食品塑化剂事件引起社会的高度关注。常用塑化剂的学名“领苯二甲酸二(2-乙基己)酯”,化学式为C24H38O4,它是一种无色透明的液体,有特殊气味,不溶于水,溶于大多数有机溶剂,有毒。常用作各种塑料制品的工业添加剂,不可食用。可是黑心业者为了牟取暴利,竟然将其添加到多种饮料、果冻、果酱和方便面等食品中。若长期食用此类食品可能对生殖系统、免疫系统造成伤害,大量摄入还可能致癌。
请分析上述信息,回答下列问题:
(1)写出塑化剂的两条物理性质;
(2)下列做法,可以使我们远离塑化剂的是;
①少喝各种饮料,日常饮水以白开水为主
②经常吃方便面、面包等速食食品以适应我们快节奏的生活
③尽量少用塑料制品直接接触热的、含油脂的食物
④呼吁政府完善食品安全监督检验机制,严惩不法黑心业者
(11分)依据氧化还原反应:2Ag+ (aq) + Cu(s) ="=" Cu2+ (aq) + 2Ag (s)设计的原电池如图所示。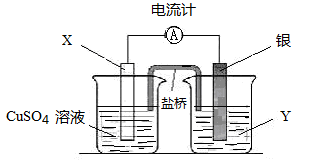
请回答下列问题:
(1)电极X的材料是;电解质溶液Y是;
(2)银电极为电池的极;银电极上发生的电极反应式。
(3)外电路中的电子是从电极流向电极(填电极的材料)。
(4)利用反应Zn + 2 FeCl3 = ZnCl2 + 2 FeCl2,设计一个原电池,在下面框图内画出有关的实验装置图:
正极的电极反应式为。