X原子在第二电子层上只有一个空轨道,其轨道表示式为 ;Y原子的3p轨道上只有一个未成对电子,则Y原子可能是 、 ; Z原子的核电荷数为26,其在元素周期表中的位置是 。
(18分)Ⅰ.某钠盐溶液中通入足量氨气,无明显现象。再在所得溶液中通入过量CO2,产生大量白色沉淀。
(1)写出氨气的电子式 。
(2)该钠盐溶液中一定不可能含有下列哪种微粒 (填编号)。
| A.Cl- | B.Fe2+ | C.SiO32- | D.AlO2- |
(3)写出一个通入过量CO2时生成白色沉淀的离子方程式 。
Ⅱ.电镀工业中往往产生大量的有毒废水,必须严格处理后才可以排放。某种高浓度有毒的含A离子(阴离子)废水在排放前的处理过程如下: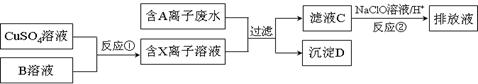
已知:9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25 g·L-1的气体1.12L。
(4)沉淀D的化学式是 。
(5)写出沉淀D在氧气中灼烧发生的化学方程式 。
(6)滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理 。
(7)反应①为制得某种元素的低价X离子,试从氧化还原反应的角度分析,是否可以用Na2SO3溶液来代替B溶液 ,并设计实验证明所用Na2SO3溶液是否变质 。
(10分)CO不仅是家用煤气的主要成分,也是重要的化工原料。工业上用简单有机物合成高分子涂料黏胶剂I的过程如下: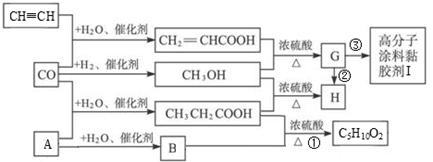
请回答下列问题:
(1)A的结构式 。
(2)G分子中官能团名称是 。
(3)写出反应①的化学方程式 ,指出②的反应类型 。
(4)写出反应③的化学方程式 。
【化学——选修5:有机化学基础】聚氯乙烯(PVC)保鲜膜的安全问题引起广泛的关注。PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。工业上用乙烯和氯气为原料经下列各步合成PVC:
(1)乙是PVC的单体,其结构简式为____________________________________________;
(2)反应③的化学方程式为____________________________________________________。
(3)写出以下反应类型:
反应①_______________________________________________________________________;
反应②_______________________________________________________________________。
(4)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸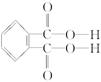 是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,其结构简式为______________________。
是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,其结构简式为______________________。
(5)聚甲基丙烯酸羟乙酯的结构简式为: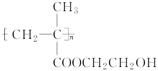 ,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式:
,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式:
①由甲基丙烯酸羟乙酯制备聚甲基丙烯酸羟乙酯______________________;
②由甲基丙烯酸制备甲基丙烯酸羟乙酯______________________________;
③由乙烯制备乙二醇_________________________________。
[化学—选修3:物质结构与性质](15分)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,C元素的气态氢化物的VSEPR模型为 。B2A4是重要的基本石油化工原料,1 mol B2A4分子中含__________molσ键。
(4)B元素可形成多种单质,一种晶体结构如图一所示;另一种的晶胞如图二所示,该晶胞的空间利用率为 (保留两位有效数字)。( )
)
(5)向E的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式 。
[化学一选修2:化学与技术](15分)合成氨的流程示意图如下: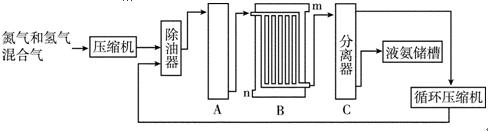
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是________、________;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式__________________________,______________________。
(2)设备A中含有电加热器、触媒和热交换器,设备A的名称是________,其中发生的化学反应方程式为___________;
(3)设备B的名称是________,其中m和n是两个通水口,入水口是________(填“m”或“n”)。不宜从相反方向通水的原因是______________________________;
(4)设备C的作用是_____________________________;
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
CO(g)+H2O(g) CO2(g)+H2(g)。已知1 000 K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于________。
CO2(g)+H2(g)。已知1 000 K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于________。