如图所示,装置B部分盛有1 L 2 mol/L Na2SO4溶液,装置A部分盛有1 L 2 mol/L AgNO3溶液。通电后,湿润的KI淀粉试纸的C端变蓝色,试回答下列问题:
⑴A中发生反应的化学方程式为 。
⑵在B中观察到的现象是 。
⑶室温下,若从电解开始到时间为T时,A、B装置中共收集到气体0.168L(标准状况),若电解过程中无其它副反应发生,且溶液体积变化忽略不计,则在时间T时,A溶液的c(H+)为 。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
(1)有四种钠的化合物,根据下列反应式判断W、X、Y、Z的化学式。
W,X,Y,Z。
①W→X+CO2↑+H2O ②Z+CO2→X+O2
③Z+H2O→Y+O2↑ ④X+Ca(OH)2→Y+CaCO3↓
(2)A、B、C、D、E五种物质的焰色反应都显黄色。A、B与水反应都有气体产生,A与水反应放出的气体有氧化性,B与水反应放出的气体有还原性,同时都生成C的溶液。C与适量的CO2反应生成D,D的溶液与过量的CO2反应生成E的溶液,E加热又变为D。填写下列空白:
①B与水反应的化学方程式:。
②D的溶液与过量的CO2反应生成E的溶液反应的化学方程式:。
已知有以下物质相互转化。试回答: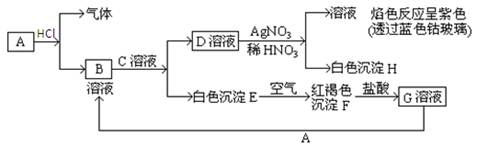
(1)写出A的化学式,B的化学式,D的化学式,F的化学式。
(2)写出由D转变成H的化学方程式。
(3)写出向G溶液加入A的有关离子反应方程式。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其余的均为短周期主族元素; ②Y原子价电子排布msnmpn ③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z的元素符号为_______,在周期表中的____分区。
(2)向Z的硫酸盐的溶液中逐滴加入R的氢化物的水溶液至过量,可观察到的现象为___________.此时Z2+与R的氢化物形成了配位数为4的配合物离子,该离子中化学键的类型有(填序号)。
A配位键 B极性共价键 C 非极性共价键 D 离子键
(3)氢化物的沸点:X的比同族其它元素高的原因是。Q和Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是_____(填序号)。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、X的第一电离能由小到大的顺序为_______________。R、X、Y四种元素的原子半径由小到大的顺序为________(均用元素符号表示)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为_____。
A、B、C、D、E、F、G均是原子序数小于36的元素。A的基态原子外围电子排布式为3s2;B原子的L电子层的P能级上有一个空轨道; C元素的基态原子最外层有3个未成对电子,次外层有2个电子; D 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2。
根据信息回答下列问题:
(1)C的外围电子排布图为。C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为;分子的VSEPR模型名称为;阴离子的立体构型为_____。
(2)G的价电子排布式为。用电子式表示化合物AE2的形成过程。
(3)F与BD易形成配合物F(BD)5,在F(BD)5中F的化合价为_______;与BD分子互为等电子体的分子和离子分别为 和 (填化学式)。
(4)E有多种含氧酸根①EO-②EO2-③EO3-④EO4-,其中空间构型为四面体型的是。(填序号)
(5)B、C、D、E原子相互化合形成的分子有多种,请列举两种分子内所有原子都满足最外层8电子稳定结构的分子:______________________(写分子式)