用CH4催化还原 NOx可以消除氮氧化物的污染。例如:
① CH4 ( g ) + 4NO2 ( g ) =" 4NO" ( g ) + CO2 ( g ) + 2H2O ( g ) ;△H=一574kJ·mol-1 ②CH4 ( g ) + 4NO ( g ) = 2N2 ( g ) + CO2 ( g ) + 2H2O ( g ) ;△H=一1160kJ·mol一1下列说法不正确的是
| A.由反应①可推知:CH4 ( g ) + 4NO2 ( g ) =" 4NO" ( g ) + CO2 ( g ) + 2H2O ( l) ; △H>一574 kJ·mol-1 |
| B.反应①②转移的电子数相同 |
| C.若用标准状况下 4.48LCH4还原 NO2至 N2,放出的热量为 173.4kJ。 |
| D.若用标准状况下 4.48LCH4还原 NO2至 N2,整个过程中转移的电子总数为1.60 mol |
已知反应X+Y= M+N为放热反应,下列说法正确的
| A.X的能量一定高于M |
| B.X和Y的总能量一定高于M和N的总能量 |
| C.Y的能量一定高于N |
| D.因该反应为放热反应,故不必加热就可发生 |
下列过程中ΔH小于零的是
| A.氯酸钾分解制氧气 |
| B.氯化铵受热分解 |
| C.氢气还原氧化铜 |
| D.实验室用锌和稀硫酸反应制氢气 |
反应:2SO2+O2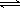 2SO3,经过一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为
2SO3,经过一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为
| A.0.1s | B.2.5s | C.5s | D.10s |
把A、B、C、D 4块金属片浸入稀硫酸中,用导线两两相连组成原电池。若A、B相连时,A为负极;C、D相连时,D上产生大量气泡;A、C相连时,电流由C经导线流向A;B、D相连时,电子由D经导线流向B,则此4种金属的活动性由强到弱的顺序为
A.A>B>C>D B.A>C>D>B
C.C>A>B>D D.B>A>C>D
在一定条件下,对于密闭容器中进行的反应:2SO2(g)+ O2(g)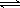 2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
| A.正、逆反应速率都等于零 | B.SO2、O2、SO3的浓度相等 |
| C.SO2、O2、SO3在容器中共存 | D.SO2、O2、SO3的浓度均不再变化 |