甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是___________________________________________________。
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:____________________________________________________。
(3)在一定条件下,甲与O2反应的化学方程式是:______________________。
(4)丁的元素符号是____,它的原子结构示意图为_________________________。
(5)丁的氧化物的晶体结构与______的晶体结构相似。
某化学课外小组设计了如下图(铁架台均已略去)所示的实验装置,进行气体性质实验。图中用箭头表示气体流向,A表示一种纯净、干燥的气体,B表示另一种气体。反应进行一段时间后,装置己中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取:N a2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。
a2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。
根据图中装置和反应现象请回答: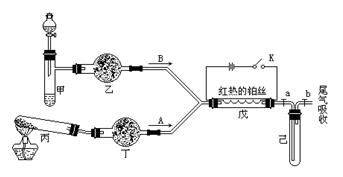
(1)丙中发生反应的化学方程式为。
(2)丁中的干燥剂应选,不选另一种干燥剂的理由是。
(3)甲中发生反应的化学方程式为 。
。
(4)戊中发生的主要反应的化学方程式为,此反应是(吸热、放热)反应,可能发生的什么现象可以证明你的判断。
下图是化学中部分常见的氧化物和单质的转化关系。其中,氧化物f是制造光导纤维的重要原料,氧化物c是一种具有磁性的黑色物质。回答下列问题: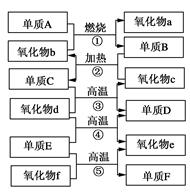
(1)写出下列物质的化学式:单质F________,氧化物d________。
(2)写出下列反应的化学方程式:
①_____________________________________________;
④_____________________________________________。
硫酸和硝酸是中学阶段常见的二种强酸。请就二者与金属铜的反应情况,回答下列问题:
(1)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是。
A.40.32L B.30.24L C.20.16L D.6.72L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式。
(2)若将过量铜粉与一定量浓 硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是,反应中所消耗的硝酸的物质的量可能为。
硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是,反应中所消耗的硝酸的物质的量可能为。
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
农业部防治高致病性禽流感工作新闻发言人2006年3月16日宣布:“广西南宁市和西藏拉萨市疫区已经解除封锁”,这标志着我国高致病性禽流感阻 击战取得了阶段性成果。金刚甲烷、金刚乙胺和达菲已经被批准用于预防人类禽流感。
击战取得了阶段性成果。金刚甲烷、金刚乙胺和达菲已经被批准用于预防人类禽流感。
(1)金刚乙胺,又名α—甲基—1—金刚烷甲基胺,其化学结构简式如下图所示,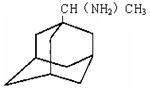
其分子式为_________,金刚乙胺碳原子上的氢原子在一定条件下可被氯原子取代,其一氯取代物有______种。
(2)金刚乙胺是金刚乙烷的衍生物,金刚乙烷有很多衍生物,它们可以相互衍变。下图就是它的部分衍生物相互衍变图。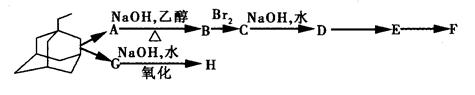
经检测发现,E分子中有两个C=O键,但与新制氢氧化铜反应得不到红色沉淀;
1 mol F与足量的钠完全反应生成22.4 L气体(标准状况下);H具有酸性,且分子式中只比F少1个O。据此回答下列问题(可用“R”表示 ):
):
①A→B.E→F的反应类型分别为_____、____。
②写出D、E、F、H的结构简式:D_、E、F、H_____。
③写出:C→D的化学方程式:_____________;
④F在一定条件下,可发生缩聚反应,形成高分子化合物I,试写出化学方程式: _ ____。
有机化合物D常用于香料工业和电镀工业。D的合成过程如图所示:
已知: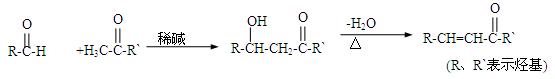
(1)①A中含氧官能团的名称是。
②A可以发生的反应是(填字母)。
a.还原反应 b.消去反应 c.水解反应 d.取代反应
(2)B是由碳、氢、氧三种元素组成的化合物,经质谱分析相对分子质量为58;分子中含有碳氧双键和2个甲基。B的结构简式
(3)D的结构简式是
(4)F可作塑料热稳定剂,由苯酚和B反应制得:
F能与NaOH反应,F分子苯环上的一 氯取代产
氯取代产 物只有两种,核磁共振氢谱显示其分子中含有4种不同类型的氢原子。F的结构简式是
物只有两种,核磁共振氢谱显示其分子中含有4种不同类型的氢原子。F的结构简式是