铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。填写下列空白:
(1)配制实验用的溶液。要配制200mL密度为1.2g·cm-3的溶质质量分数为16%
的NaOH溶液,需要称取 gNaOH固体。
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜的离子方程式 。
(3)如图,组装好仪器,接通开关K,通电约25min。在阳极生成氧化铝,阴极产生气体。写出该过程中的电极反应式:
阳极
阴极
(4)断开电路,取出铝片,用1%稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式
用下图所示的装置进行电解。通电一会儿,发现湿润的KI淀粉试纸的C端变为蓝色。则: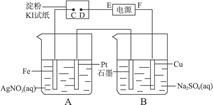
(1)A中发生反应的化学方程式为_________________________________。
(2)在B中观察到的现象是__________________________、______________________、______________________。
(3)室温下,若从电解开始到时间t s时,A、B装置中共收集到标准状况下的气体0.168 L,若电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000 mL,则A溶液的pH为______________________。
(1)阿波罗宇宙飞船使用的是以KOH为介质的氢、氧燃料电池(如下图),按下列要求填空: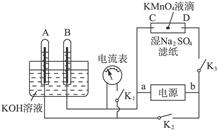
(1)①__________(填“负”或“阴”)极反应式:;②__________(填“正”或“阳”)极反应式:_________________;③电池反应式_________________________________。
(2)如图所示装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3通直流电,回答下列问题:
①判断电源的正、负极:a为___________极,b为极___________。
②在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象?______________________。
③写出电极反应式:A极______________________,C极______________________。
④若A极产生气体的体积在标准状况下为x L,则C极上产物的质量大约为___________g。
⑤若电解一段时间后,A、B中均有气体包围电极,此时切断K2、K3,闭合K1,则电流表的指针是否移动___________(填“是”或“否”)。若电流表指针不移动说明理由,若指针移动也说明理由。
如下图所示,若电解5 min铜电极质量增加2.16 g。试回答: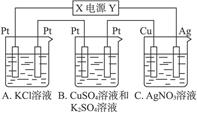
(1)电极X是电源的___________极。
(2)pH变化:A___________;B___________;C___________。
(3)若A中KCl溶液的体积为200 mL,电解至5 min溶液的pH是__________(假设溶液体积不变化)。
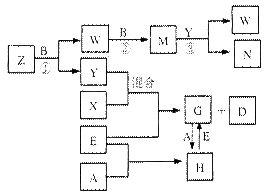 A、B、C、D、E是中学化学常见的五种单质,已知A、B、C、D在常温下均为气态,E为金属,其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。
A、B、C、D、E是中学化学常见的五种单质,已知A、B、C、D在常温下均为气态,E为金属,其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。
(1)化合物Z的空间构型为;构成A的元素的最高价氧化物水化物的化学式为;实验室贮存N的方法是。
(2)写出反应②的化学反应方程式;G→H的离子方程式。
(3)常温下,D与A反应生成1 mol X时放热92.3kJ,写出该反应的热化学方程式:
。
(4)将过量的E加入N的稀溶液中,若反应过程中转移电子的数目为3.01×1023,则参加反应的E的质量为g。
已知:G是一种常用的药用有机物,合成路线如图所示:
①有机物A和C都能与FeCl3发生显色反应,且取代基处于邻位
②有机物G只含碳、氢、氧元素且式量小于200,氧元素的质量分数为35.56%。
请回答:
(1)写出A、C、K的结构简式A________C________K__________
(2)反应①~⑨中,属于取代反应的有______________(填序号)
(3)写出F的常见同分异构体与F在浓硫酸条件下的反应_____________________
(4)写出G在加热条件下与NaOH溶液反应的化学方程式_______________________
(5)写出反应⑥的方程式____________________。