常见铅蓄电池是二次电池,其电极材料分别为Pb和PbO2,电解液为稀H2SO4溶液,工作时的总反应式为Pb +PbO2+ 2H2SO4 2PbSO4 +2H2O。请依据上述情况判断:⑴铅蓄电池的负极材料是 。
2PbSO4 +2H2O。请依据上述情况判断:⑴铅蓄电池的负极材料是 。
⑵请依据两极材料和总反应,写出放电时正极反应是 。
⑶请依据总反应式和正极反应式,写出放电时负极反应是 。
⑷放电时,电解质溶液中阴离子移向 极;电流方向从 极流向 极。
⑸放电时,电解质溶液的酸性 (填“增强”、“减弱”或“不变”)。
⑹充电时PbO2极发生 反应,电极反应式 ;Pb极发生 反应,电极反应式 。
乙烯的产量标志着一个国家的石油化工发展水平,它是很重要的工业原料.
(1)已知聚苯乙烯塑料的单体是苯乙烯(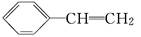 ),由苯乙烯合成聚苯乙烯塑料属于________反应;苯乙烯也能使溴水褪色,其反应的化学方程式为___________________.
),由苯乙烯合成聚苯乙烯塑料属于________反应;苯乙烯也能使溴水褪色,其反应的化学方程式为___________________.
(2)乙烯的某同系物A(化学式为C5H10)和H2加成后的产物的一氯取代物有3种,试写出A可能有的结构简式:___________________________________________________.
有A、B、C三种有机物,A是一种环状烃,其中碳、氢两种元素的质量比为6∶1,气体A的质量是相同状况下同体积空气质量的1.448倍.B是A的同分异构体,能使酸性高锰酸钾溶液退色.B跟溴水反应生成C.则A、B、C的结构简式分别是________________,__________________,_________________________.
下面是我们已经学过的烷烃或烯烃的化学反应,请写出其反应的化学方程式,指出反应类型.
(1)乙烷与氯气生成一氯乙烷的反应:____________________________________
____________________,__________________.
(2)乙烯与溴水的反应:_______________________________________________,
________.
(3)乙烯与水的反应:__________________________________________________,
________.
(4)乙烯生成聚乙烯的反应:_______________________________________________,
____________.
化学上常用燃烧法确定有机物的组成.下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品.根据产物的质量确定有机物的组成.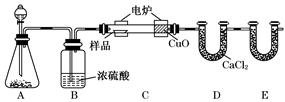
回答下列问题:
(1)A装置中分液漏斗盛放的物质是______________,写出有关反应的化学方程式
______________________________________________________________.
(2)C装置(燃烧管)中CuO的作用是______________________________________
____________________________.
(3)写出E装置中所盛放试剂的名称__________,它的作用是______________.
(4)若将B装置去掉会对实验造成什么影响? __________________________.
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种).经充分燃烧后,
E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为______________.
(6)要确定该有机物的化学式,还需要测定________________________.
质子核磁共振谱(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一结构中的等性氢原子在PMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的H原子数成正比.例如,乙醛的结构式为CH3CHO,其PMR谱中有两个信号,其强度之比为3∶1.
分子式为C3H6O2的有机物,如果在PMR谱上观察到的氢原子给出的峰有两种情况.第一种情况峰给出的强度比为3∶3,请写出其对应化合物的结构简式_________________.
第二种情况峰的强度比为3∶2∶1,请写出该化合物的可能的结构简式___________.