将 1molSO2和1molO2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,SO3为0.3mol。若此时移走0.5molO2和0.5molSO2,则重新达到平衡后,SO3的物质的量为 ( )
| A.0.3mol | B.0.15mol |
| C.小于0.15mol | D.大于0.15mol,小于0.3mol |
家里的食用花生油不小心混入了大量的水,采用最简便的分离方法是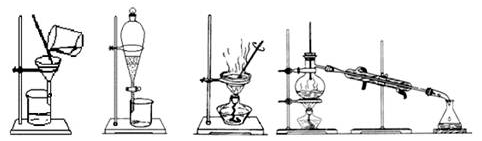
A B C D
将下图所示实验装置的K闭合,下列判断正确的是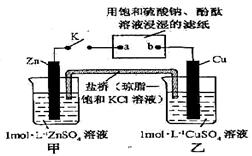
A.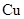 电极上发生还原反应 电极上发生还原反应 |
B.电子沿Zn a a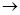 b b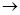 Cu路径流动 Cu路径流动 |
| C.片刻后甲池中c(SO42—)增大 |
| D.片刻后可观察到滤纸b点变红色 |
以溴乙烷为原料制备1,2二溴乙烷,下列方案中最合理的是( )
A.CH3CH2Br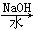 CH3CH2OH CH3CH2OH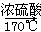 CH2=CH2 CH2=CH2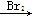 CH2BrCH2Br CH2BrCH2Br |
B.CH3CH2Br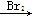 CH2BrCH2Br CH2BrCH2Br |
C.CH3CH2Br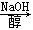 CH2=CH2 CH2=CH2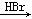 CH2BrCH3 CH2BrCH3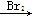 CH2BrCH2Br CH2BrCH2Br |
D.CH3CH2Br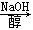 CH2=CH2 CH2=CH2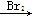 CH2BrCH2Br CH2BrCH2Br |
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是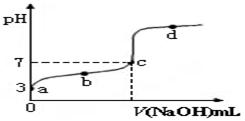
| A.a点时,CH3COOH的电离度是1% |
| B.b点时,溶液中c(CH3COO-)>c(Na+) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中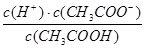 均等于K 均等于K |
中国国家主席胡锦涛在中非合作论坛北京峰会上承诺:“提供3亿元人民币无偿援款帮助非洲防治疟疾,用于提供青蒿素药品及设立30个抗疟中心”。中国研制成功的全球唯一的治疗疟疾特效药——青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示。目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求。下列关于青蒿素的说法正确的是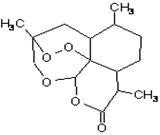
| A.是一种烃 | B.属于高分子化合物 |
| C.属于芳香族化合物 | D.分子式是C15H22O5 |