用MnO2和浓盐酸反应制取氯气时,当有4mol e-转移时,生成的氯气在标准状况下的体积为
| A.22.4L | B.11.2L |
| C.44.8L | D.89.6L |
在25 ℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ,下列表示甲醇燃烧热的热化学反应方程式是
A.CH3OH(l) +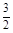 O2(g)=CO2(g)+2H2O(l)△H=+725.8 kJ·mol-1 O2(g)=CO2(g)+2H2O(l)△H=+725.8 kJ·mol-1 |
| B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452 kJ·mol-1 |
C.CH3OH(l) +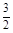 O2(g)=CO2+2H2O△H=-725.8 kJ·mol-1 O2(g)=CO2+2H2O△H=-725.8 kJ·mol-1 |
D.CH3OH(l) +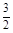 O2(g)=CO2(g)+2H2O(l)△H=-725.8 kJ·mol-1 O2(g)=CO2(g)+2H2O(l)△H=-725.8 kJ·mol-1 |
已知:N2+O2 2NO△H=+180 kJ/mol,其中N≡N,O=O键的键能分别是946 kJ/mol、498 kJ/mol,则NO中化学键的键能为
2NO△H=+180 kJ/mol,其中N≡N,O=O键的键能分别是946 kJ/mol、498 kJ/mol,则NO中化学键的键能为
| A.812 kJ/mol | B.632 kJ/mol | C.1264 kJ/mol | D.1624 kJ/mol |
NaF、NaI、和MgO均为离子晶体,有关数据如下表:
| 物质 |
① NaF |
② NaI |
③ MgO |
| 离子电荷数 |
1 |
1 |
2 |
| 键长(10-10m) |
2.31 |
3.18 |
2.10 |
试判断,这三种化合物熔点由高到低的顺序是
A.③>①>② B.③>②>① C.①>②>③ D.②>①>③
一定条件下,在固定容积密闭容器中发生可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
| A.达到化学平衡时,化学反应速率的关系是2v逆(NH3)=3v正 (H2O) |
| B.达到化学平衡时,NH3、O2、NO、H2O物质的量之比为4∶5∶4∶6 |
| C.混合气体的密度一定时,该化学反应达到化学平衡 |
| D.若单位时间内生成x mol NO的同时,生成x mol NH3,则反应达到平衡状态 |
在2 L密闭容器中发生反应4A(s)+3B(g)=2C(g)+D(g),经2 min,B的物质的量减少0.6 mol,下列对该反应速率表示正确的是
A.在2 min末的反应速率:v (B)=0.3 mol·L-1·min-1
B.用A表示的反应速率为:v (A)=0.4 mol·L-1·min-1
C.用D表示的平均反应速率为:v (D)= 0.05 mol·L-1·min-1
D.分别用B、C表示的反应速率其比值为2∶3