对于3 Fe(s)+ 4H2O(g)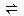 Fe3O4(s)+ 4H2(g),反应的化学平衡常数的表达式为( )
Fe3O4(s)+ 4H2(g),反应的化学平衡常数的表达式为( )
A.K==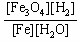 |
B.K==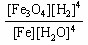 |
C.K==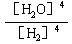 |
D.K==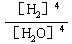 |
将0.2molMnO2和50mLl2mol·L-1盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为()(不考虑盐酸的挥发)
| A.等于0.3 mol |
| B.小于0.3mol |
| C.大于0.3mol、小于0.6mol |
| D.以上结论都不正确 |
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是()
| A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
| B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 |
| C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |
把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
| A.0.1 ( b – 2a ) mol/L | B.10 ( 2a – b ) mol/L |
| C.10 ( b – a ) mol/L | D.10 ( b – 2a ) mol/L |
下列各说法正确的是
| A.弱电解质的导电能力一定比强电解质的导电能力弱 |
| B.pH=4的醋酸与pH=10的NaOH溶液等体积混合后溶液显碱性 |
| C.豆浆中加入硫酸钙会使蛋白质聚沉. |
| D.同浓度①NaHCO3、②Na2CO3、③CH3COONa四种溶液,pH大小顺序是②>③>① |
市场上销售的“84”消毒液,其商品标识上有如下叙述:①本品为无色液体,呈碱性②使用时加水稀释③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是( )
| A.Cl2 | B.SO2 | C.NaClO | D.KMn04 |