有一系列化合物按以下顺序排列: CH3CH =" CHCHO" ,CH3CH =" CHCH" =" CHCHO" , CH3(CH=CH)3CHO ,……
在该系列有机物中,分子中碳元素质量分数的最大值接近于( )。
| A.95.6% | B.92.3% | C.85.7% | D.75.0% |
下列关于化学用语“NH4Cl”的意义,不正确的是( )。
A.氯化铵分子中含有一个N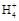 和一个Cl- 和一个Cl- |
| B.氯化铵由N、H、Cl三种元素组成 |
C.氯化铵晶体由N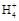 和Cl-构成 和Cl-构成 |
| D.氯化铵晶体中阴、阳离子个数比为1∶1 |
(双选)下列电子式有误的是( )。
A.氯原子∶ · · |
B.硫离子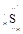 |
C.溴离子[∶Br∶]- | D.钙离子Ca2+ |
下列说法正确的是( )。
| A.离子键就是阴、阳离子间的静电引力 |
| B.所有金属元素与所有非金属元素间都能形成离子键 |
| C.钠原子与氯原子结合成氯化钠后体系能量降低 |
| D.在离子化合物CaCl2中,两个氯离子间也存在离子键 |
元素周期表在指导科学研究和生产实践方面具有十分重要的意义,请将下表中A、B两栏描述的内容对应起来。
| A |
B |
A |
B |
| ①制半导体的元素 |
(a)ⅢB至ⅥB的过渡元素 |
① |
|
| ②制催化剂的元素 |
(b)F、Cl、Br、N、S“三角地带” |
② |
|
| ③制耐高温材料的元素 |
(c)金属与非金属元素分界线附近 |
③ |
|
| ④制制冷剂的元素 |
(d)相对原子质量较小的元素 |
④ |
|
| ⑤地壳中含量较多的元素 |
(e)过渡元素 |
⑤ |
第二周期元素R,它的最外电子层达到稳定结构所需电子数小于最外层达到稳定结构时的电子数和最内层电子数之差,并且等于最内层电子数的整数倍。则关于R的正确说法是( )。
| A.常温下能稳定存在的R的氧化物都能和烧碱溶液起反应 |
| B.R最高价氧化物对应水化物都是强酸 |
| C.R的最简单氢化物可能有两种,其稳定性一种比NH3强,另一种比NH3弱 |
| D.R的最简单氢化物受热时都易分解 |