②X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是___________,Z是___________。
(2)写出③中反应的化学方程式:____________________________________________。
(3)写出④中反应的化学方程式:____________________________________________。
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下: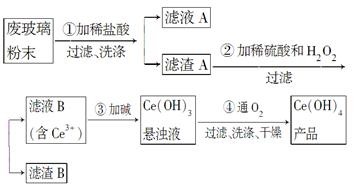
(1)洗涤滤渣A的目的是为了去除________(填离子符号),检验该离子是否洗净的方法是___________________________________________________。
(2)第②步反应的离子方程式是__________________________________,滤渣B的主要成分是________。
(3)萃取是分离稀土元素的常用方法。已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4标准溶液滴定终点(铈被还原为Ce3+),消耗25.00 mL标准溶液,该产品中Ce(OH)4的质量分数为________。
蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀的pH |
1.5 |
3.3 |
9.4 |
| 完全沉淀的pH |
3.7 |
5.2 |
11.0 |
实验步骤如下: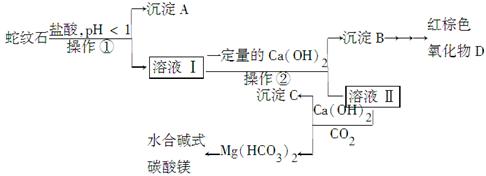
(1)实验室完成操作①所用到的玻璃仪器有:________。
(2)操作②中应控制溶液pH的合理范围是________(填序号)。
A.小于1.5 B.1.5~3.3 C.7~8 D.大小9.4
(3)检验溶液Ⅱ中是否含有Fe3+的操作与结论是______________________。
(4)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为________,再进行________、洗涤、________(依次填写实验操作名称)。
熟悉和使用中学化学实验中常见仪器及用途,是化学学习的基本要求。试回答下列问题。
(1)在仪器a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是________(填序号)。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,在下列仪器中,没有用到“磨砂”工艺处理的有________(填序号)。
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶)
d.集气瓶 e.酸式滴定管 f.碱式滴定管
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体,可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。试回答下列问题: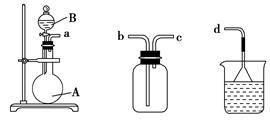
甲 乙 丙
①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为________,制取该气体利用了B的性质有________、________。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为________。
②若在乙中收集氨气,气体流经装置的顺序是:a―→____―→_____―→d(填接口代号)。
现有五种可溶性物质A、B、C、D、E,它们所含阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3—、CO32—、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是________和________(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记为C,当C与B溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴入稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为________。
A.SO32— B.SO42— C.CH3COO-D.SiO32—
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的________(填相应的离子符号)。有关反应的离子方程式为___________________。
(4)利用上述已经确定的物质,可以检验出D、E中的阳离子,请简述实验操作步骤、现象及结论:__________________________________________。
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_____________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_______________________________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是_______________,
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。