短周期元素W、X、Y、Z在元素周期表中的位置如图所示。
其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
(1)W在元素周期表中的位置是 。
(2)Z的原子结构示意图为 。
(3)下列选项中,能证明元素非金属性X强于W的是 。
| A.原子序数:X>W |
| B.最低化合价:X>W |
| C.最简单氢化物的稳定性:X>W |
| D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如下图所示的转化:
其中化合物D是一种白色沉淀,则B中溶质的化学式为 ;
C转化生成D的离子方程式为 。
(5)表中Y的最高价氧化物对应水化物的化学式为Y(OH)n ,在T℃时,其饱和溶液能使酚酞试液变红,原因是其溶液中的c(OH—) = mol·L—1 (填计算数值,已知:T℃,Ksp[Y(OH) n]=4.0×l0-12)。
工业制备的高锰酸钾是锰的重要化合物和常用的氧化剂。以下附图是工业上用软锰矿制备高锰酸钾的一种工艺流程。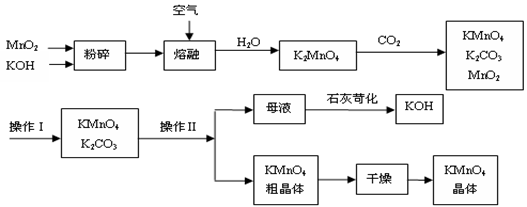
⑴KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_____(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
⑵上述流程中可以循环使用的物质有、(写化学式)。
⑶若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得mol KMnO4。
⑷操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
以石油裂解气为原料,通过一系列化学应可得到重要的化工产品增塑剂G。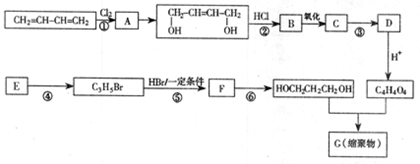
(1)E是一种石油裂解气,能使酸性高锰酸钾溶液褪色。同温同压下,E的密度是H2的21倍。核磁共振氢谱显示E有3种不同化学环境的氢原子,其个数比为1:2:3。E的结构简式为。
(2)反应类型:①,④。
(3)反应条件:③,⑥。
(4)反应②、③的目的是。
(5)反应⑤的化学方程式为。
(6)B被氧化成C的过程中会有中间产物生成,该中间产物可能是(写出一种物质的结构简式),检验该物质存在的试剂是。
(7)G的结构简式为。
氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)氨气催化氧化的化学方程式为。 (2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol。
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol。
有关键能:N="N945.6kJ/mol" N-H391.0kJ/mol,则H—H键能为。
(3)500°C、50Mpa时,在容积为VL的定容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值为。
(4)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得。部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
| 物质 |
△H(kJ/mol) |
| H2(g) |
-285.8 |
| CO(g) |
-283.0 |
| CH4(g) |
-890.3 |
已知1 mol H2O(g)转变为1molH2O(l)时放热44.0kJ。写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制取新型燃料电池。写出该电池的正极反应式。
(6)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
,溶液中离子浓度从大到小的顺序是。
下表是元素周期表的一部分,A、B、C、D、E、X、Y是一表中给出元素组成的常见单质或化合物。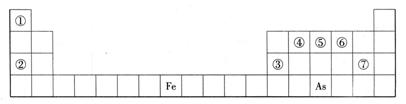
I.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)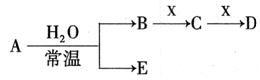
(1)若E为氧化物,则A的化学式为,A与水反应的化学方程式为。
①当X是碱性盐溶液,C分子中有22个电子时,则C的电子式为,表示X呈碱性的离子方程式为。
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为。
(2)若E为单质气体,D为白色沉淀,A的化学式可能是,B含有的化学键类型为,C与X反应的离子方程式为。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式。t°C时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的平衡常数K=1,D的转化率为。
II.元素周期是人们研究物质性质的重要工具。
(1)As在周期表中的位置。
(2)As的原子结构示意图为,其氢化物的化学式为。
(3)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂。As可与Y的溶液反应,生成As最高价含氧酸,该反应的化学方程式为,当消耗1mol还原剂时,电子转移了mol。
小苏打、胃舒平都是常用的中和胃酸的药物。
(1)若小苏打每片含0.42gNaHCO3,则2片小苏打片和胃酸完全中和,被中和的氢离子是mol。
(2)若胃舒平每片含0.195gAl(OH)3,则中和胃酸时,6片小苏打片相当于胃舒平片。