(12分)A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子化合物;B与Z的最外层电子数之比为2∶3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液 变红.请回答
变红.请回答 下列问题.
下列问题.
(1)Z原子的电子式为 ;化合物BA4的电子式为 .
(2)化合物Y2X2中含有的化学键类型有________(填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)化合物A2X和A2Z中,沸点较高 的是________(填化学式),其主要原因___________.
的是________(填化学式),其主要原因___________.
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为________.
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
(1)二价铜离子的电子排布式为 。已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释 。
(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。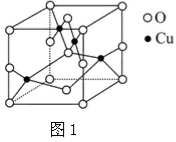
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:
(4)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为 ,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是 。
(5)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3在BF3·NH3中B原子的杂化方式为 ,B与N之间形成配位键,氮原子提供 。
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为 。
六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3。(只要求列算式)。
水是一种重要的自然资源,是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康,请回答下列问题:(1)某贫困山区,为了寻找合适的饮用水,对山上的泉水进行了分析化验,结果显示,水中主要含Ca2+、Mg2+、Cl﹣和SO42﹣.则该硬水属于 (填“暂时”或“永久”)硬度,若要除去Ca2+、Mg2+,可以往水中加入石灰和纯碱,试剂加入时先加 后加 。
(2)我国规定饮用水的硬度不能超过25度,硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1升水中含有10mg CaO称为1度,某化学实验小组对本地区地下水的硬度进行检测。
实验中涉及的部分反应:
M2+(金属离子)+EBT﹣(铬黑T)═MEBT+
蓝色酒红色
M2+(金属离子)+Y4﹣(EDTA)═MY2﹣
MEBT++Y4﹣(EDTA)═MY2﹣+EBT﹣(铬黑T )
实验过程:
①取地下水样品25.00mL进行预处理,写出由Mg2+引起的暂时硬度的水用加热方法处理时所发生反应的化学方程式: 。
②预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是 。
③将处理后的水样转移到250mL的锥形瓶中,加入氨水﹣氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.010 00mol•L﹣1的EDTA标准溶液进行滴定,滴定终点时共消耗EDTA溶液15.00mL,则该地下水的硬度为 。
(3)某工业废水中含有CN﹣和Cr2O72﹣等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
回答下列问题:
①流程②中,反应后无气体放出,该反应的离子方程式为 。
②含Cr3+废水需进一步处理,请你设计一个处理方案: 。
某硫酸厂用以下几种方法处理SO2尾气。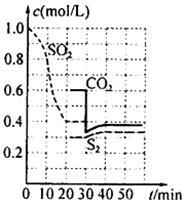
(1)活性炭还原法
反应原理:恒温恒容2C (s)+2SO2(g) S2(g)+2CO2(g) 。
S2(g)+2CO2(g) 。
反应进行到不同时间测得各物质的浓度如图:
①第一次出现平衡的时间是第 min;
②0~20min反应速率表示为V(SO2)= ;
③30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是 ;40min时,平衡常数值为__________。
(2)亚硫酸钠吸牧法
①Na2SO3溶液吸收SO2的离子方程式为 ;
②常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)
a.c(Na+)+c(H+) >c(SO32-)+c(HSO3-)+ c(OH-)
b.c(Na+) = c(SO32-) + c(HSO3-)+ C(H2SO3)
c.c(Na+)> c(SO32-)> c(OH-)>c(H+)
d.水电离出c(OH一)=l×l0-8 mol/L,
(3)电化学处理法
如图所示,Pt(1)电极的反应式为 ;碱性条件下,用Pt(2)电极排出的S2O42-溶液吸收NO2,使其转化为N2,同时有SO32-生成。若阳极转移电子6mol,则理论上处理NO2气体 mol。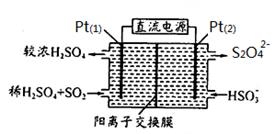
硫酸法是现代氧化铍或氢氧化铍生产中广泛应用的方法之一, 其原理是利用预焙烧破坏铍矿物(绿柱石—3BeO· Al2O3·6SiO2及少量FeO等)的结构与晶型, 再采用硫酸酸解含铍矿物, 使铍、铝、铁等酸溶性金属进入溶液相, 与硅等脉石矿物初步分离, 然后将含铍溶液进行净化、除杂, 最终得到合格的氧化铍( 或氢氧化铍) 产品, 其工艺流程如右图。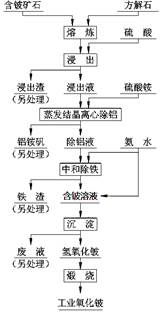
已知:(1)铝铵矾的化学式是NH4Al(SO4)2·12H2O
(2)铍元素的化学性质与铝元素相似
根据以上信息回答下列问题:
(1)熔炼物酸浸前通常要进行粉碎,其目的是:
(2)“蒸发结晶离心除铝”若在中学实验室中进行,完整的操作过程是______________洗涤、过滤。
(3)“中和除铁”过程中“中和”所发生反应的离子方程式是__________________,用平衡原理解释“除铁”的过程___________________________。
(4)加入的“熔剂”除了流程中的方解石外,还可以是纯碱、石灰等。其中, 石灰具有价格与环保优势, 焙烧时配料比( m石灰/ m绿柱石) 通常控制为1:3, 焙烧温度一般为1400℃—1500℃ 。若用纯碱作熔剂,SiO2与之反应的化学方程式是__________________________,若纯碱加入过多则Al2O2、BeO2也会发生反应,其中BeO与之反应的化学方程式是_______________________,从而会导致酸浸时消耗更多硫酸,使生产成本升高,结合离子方程式回答成本升高的原因___________________________。
铜、铁及其化合物在工业、农业、科技和日常生活中有广泛应用。
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应(已知1 molCu2S失去10mol的电子),写出该反应的离子方程式 。
(2)工业上利用废铜屑、废酸(含硝酸、硫酸)为主要原料制备硫酸铜晶体。某含有c(HNO3)="2" mol·L—1,c(H2SO4)="4" mol·L—1的废酸混合液100 mL(不含其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4·5H2O)的质量为 。
(3)现有一块含有铜绿的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。(已知:金属生锈率= )
)
①上述铜片中铜的生锈率为 (结果保留2位有效数字)
②固态铜与适量氧气反应,能量变化如下图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式 。
(4)高铁酸盐在能源环保等领域有广泛用途,如高铁酸钾(K2FeO4) 因有强氧化性,能杀菌消毒,产生Fe(OH)3有吸附性,是一种新型净水剂,用如下图所示的装置可以制取少量的高铁酸钾。
(已知爱迪生蓄电池的反应式为: )
)
①爱迪生蓄电池的负极材料是
②写出制取高铁酸钾阳极的电极反应式
③当生成19.8g的K2FeO4时,隔膜两侧电解液的质量变化差(△m右一△m左)为_ g。