为提纯下列物质(括弓内为杂质),选用的除杂试剂和分离方法都正确的是
| |
物质 |
除杂试剂 |
分离方法 |
| A |
二氧化硅(碳酸钙) |
氢氧化钠 |
重结晶 |
| B |
硫酸铜溶液(硫酸铁) |
加入过量铜粉 |
过滤 |
| C |
乙醇(乙酸) |
生石灰 |
蒸馏 |
| D |
苯(苯酚) |
浓澳水 |
分液 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.c(OH-)/c(H+)=1012的溶液中:SO32-、NH4+、NO3-、K+ |
| B.c(I-)=0.1 mol·L-1的溶液中:Na+、NH4+、ClO-、SO42- |
| C.加入Mg能放出H2的溶液:Na+、Al3+、Cl-、SO42- |
| D.加入苯酚显紫色的溶液:NH4+、K+、Cl-、S2- |
下列离子方程式与所述事实相符且正确的是
A.由FeCl3溶液制取Fe(OH)3胶体:Fe3+ + 3H2O  Fe(OH)3胶体 + 3H+ Fe(OH)3胶体 + 3H+ |
| B.小苏打与氢氧化钠溶液混合:HCO3- + OH- = CO2↑+H2O |
| C.向明矾溶液中加入过量的氢氧化钡溶液:Al3+ + SO42- + Ba2+ + 4OH- = BaSO4↓ + AlO2- + 2H2O |
| D.向水玻璃中通足量CO2:SiO32- + CO2 + H2O = H2SiO3↓ + HCO3- |
.硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见图3)。下列说法正确的是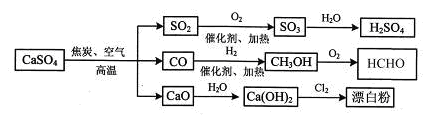
图3
| A.CO、SO2、SO3均是酸性氧化物 |
| B.工业上利用Cl2和澄清石灰水反应来制取漂白粉 |
| C.除去与水反应,图3所示转化反应均为氧化还原反应 |
| D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100% |
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S和无毒的气体。已知:
①CO(g)+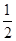 O2(g)=CO2(g)
O2(g)=CO2(g) H=-283.0 kJ·mol-1
H=-283.0 kJ·mol-1
②S(g)+ O2(g)=SO2(g) H=-296.0 kJ·mol-1
H=-296.0 kJ·mol-1
下列说法正确的是
| A.CO的燃烧热为566.0 kJ·mol-1 |
B.反应② H<0,所以该反应能自发进行 H<0,所以该反应能自发进行 |
| C.使用催化剂能提高其转化率 |
| D.根据①和②推知总反应为2CO(g)+SO2(g)=S(s)+2CO2 (g) △H=-270kJ·mol-1 |
下列有关实验操作、现象和解释或结论都正确的是
| 选项 |
实验操作 |
现象 |
解释或结论 |
| A |
向浑浊的苯酚试液中加入饱和Na2CO3溶液 |
溶液变澄清 |
酸性:苯酚>碳酸 |
| B |
AgCl沉淀中滴入Na2S溶液 |
白色沉淀变黑色 |
Ag2S比AgCl更难溶 |
| C |
向AlCl3溶液中滴入适量NaOH溶液 |
产生白色沉淀 |
Al(OH)3不溶于碱 |
| D |
用玻璃棒蘸取某溶液在酒精喷灯上灼烧 |
火焰呈黄色 |
说明该溶液中一定含钠元素 |