将质量相等的铜片和铂片插入硫酸铜溶液中,铜片与电源正极相连,铂片与电源负极相连,以电流强度1A通电10min,然后将电源反接,以电流`强度为2A继续通电10min。试回答:
(1)铜电极和铂电极质量为横坐标,时间为纵坐标,分别作出铜电极、铂电极的质量和时间的关系图。
(2)上述过程中发生的现象是:铜电极 ;
铂电极 。
(3)最后时刻两电极的电极反应式:
铜电极 ;
铂电极 。
下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,回答下列问题:
| 族 周期 |
I A |
ⅡA |
ⅢA |
ⅣA |
VA |
ⅥA |
ⅦA |
0 |
| 一 |
① |
|||||||
| 二 |
② |
③ |
④ |
|||||
| 三 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(写化学式)。
(2)由表中元素可以组成多种漂白剂,试写出其中两种常用漂白剂的化学式:、。
(3)①、④、⑤三种元素形成的化合物中化学键的类型:。
(4)②和④形成的化合物与④和⑤形成的化合物之间发生氧化还原反应,写出该反应的化学方程式:。
(5)由表中元素形成的常见物质X、Y、Z、M、W可发生以下反应: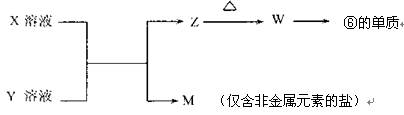
①X溶液与Y溶液反应的离子方程式为;
②已知M为硝酸盐,则M溶液中各离子浓度由大到小排列顺序为:
c()>c()>c()>c()(在括号内填离子符号)。
已知A物质是一种气态烷烃,标况下取22.4L该烃完全燃烧消耗氧气的质量是160g,A的一氯代物有两种同分异构体分别为B和C。各物质转化关系如下图所示:(部分反应物及产物略去)
又知:H不能发生银镜反应,请从反应图式中各物质间的关系,回答下列问题:
(1)写出下列物质的结构简式:
A、C。
(2)写出下列反应的化学方程式:(注明反应条件及反应类型)。
A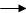 B:反应类型。
B:反应类型。
B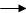 D:反应类型。
D:反应类型。
E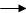 H:反应类型。
H:反应类型。
G+E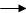 I:反应类型。
I:反应类型。
(3)已知H的一种同分异构体K能发生银镜反应,写出K与银氨溶液反应的化学方程式:
。
(1)已知某有机物的结构简式为: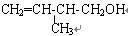 ,该有机物中所含官能团的名称是_______________________________,写出该有机物属于酮的同分异构体(用结构简式表示)
,该有机物中所含官能团的名称是_______________________________,写出该有机物属于酮的同分异构体(用结构简式表示)
(2)已知某高分子化合物的结构简式为: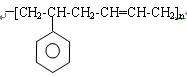
写出合成该高分子化合物的单体(用结构简式表示)
下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑥ |
⑧ |
⑩ |
|||||
| 3 |
① |
③ |
⑤ |
⑦ |
⑨ |
|||
| 4 |
② |
④ |
11 |
 (1)这11种元素中,化学性质最不活泼的元素是(用元素符号或化学式表示,下同),得电子能力最强的原子对应的单质是,失电子能力最强的原子对应的单质与水反应的化学方程式是。常温下为液态的非金属单质是。
(1)这11种元素中,化学性质最不活泼的元素是(用元素符号或化学式表示,下同),得电子能力最强的原子对应的单质是,失电子能力最强的原子对应的单质与水反应的化学方程式是。常温下为液态的非金属单质是。
(2)元素④的离子结构示意图为。
(3)⑥、⑦、⑧气态氢化物的化学式分别为、、,其中以最稳定。⑦、⑨两种元素最高价氧化物对应水化物的化学式分别为:、;其中以酸性最强。
(4)③和⑨两种元素形成的化合物属于(填“离子化合物”或“共价化合物”),请用电子式表示其形成过程。
(5)写出③的单质置换出⑥的单质的化学方程式。
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示: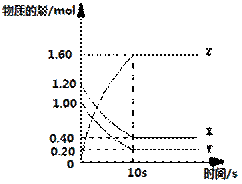
(1)该反应的化学方程式为:。
(2)反应开始至10s末,X的平均反应速率为:。
(3)若在第10s时分离出部分Y,则容器中X的物质的量会________(填“增大”、“减小”或“不变”)。