化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下的方法来制备这种材料并测定这种材料的组成。
Ⅰ.制备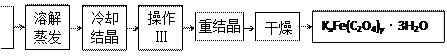 K2C2O4
K2C2O4
FeCl3
⑴结晶时应将溶液用冰水冷却并在黑暗处等待晶体的析出,这样操作的原因是:_________________
_______________________________________________。
⑵操作Ⅲ的名称是___________。
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.1000 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00mL时恰好完全反应;再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。相关反应的化学方程式如下:
2 KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
⑶配制100mL 0.1000 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有_______________________________(填仪器名称)。两个滴定中,终点时溶液颜色为________色,且30 秒内不变色。
⑷该化合物KxFe(C2O4)y·3H2O中,x=_______。
 从铝土矿(主要成分是
,含
、
、
等杂质)中提取两种工艺品的流程如下:
从铝土矿(主要成分是
,含
、
、
等杂质)中提取两种工艺品的流程如下:


请回答下列问题: (1)流程甲加入盐酸后生成
的方程式为.
(1)流程甲加入盐酸后生成
的方程式为. (2)流程乙加入烧碱后生成
的离子方程式为.
(2)流程乙加入烧碱后生成
的离子方程式为. (3)验证滤液
含
,可取少量滤液并加入填试剂名称)。
(3)验证滤液
含
,可取少量滤液并加入填试剂名称)。 (4)滤液
中溶质的主要成份是(填化学式),写出该溶液的一种用途_
(4)滤液
中溶质的主要成份是(填化学式),写出该溶液的一种用途_ (5)已知298
时,
的容度积常数
=5.6×10-12,取适量的滤液
,加入一定量的烧碱达到沉淀溶液平衡,测得
=13.00,则此温度下残留在溶液中的
=.
(5)已知298
时,
的容度积常数
=5.6×10-12,取适量的滤液
,加入一定量的烧碱达到沉淀溶液平衡,测得
=13.00,则此温度下残留在溶液中的
=.
 以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略); (1 )从废液中提纯并结晶处
。
(1 )从废液中提纯并结晶处
。 (2)将
溶液与稍过量的
溶液混合,得到含
(2)将
溶液与稍过量的
溶液混合,得到含
 (3)将浊液过滤,用90°C热水洗涤沉淀,干燥后得到
固体
(3)将浊液过滤,用90°C热水洗涤沉淀,干燥后得到
固体 (4)煅烧
,得到
固体
(4)煅烧
,得到
固体 已知:
在热水中分解
已知:
在热水中分解 (1)中,加足量的铁屑出去废液中的
,该反应的离子方程式是。
(1)中,加足量的铁屑出去废液中的
,该反应的离子方程式是。
(2)中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用。
 (3 )中,生成
的离子方程式是。若
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
(3 )中,生成
的离子方程式是。若
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
 (4)中,通过检验
来判断沉淀是否洗涤干净。检验
操作是是。
(4)中,通过检验
来判断沉淀是否洗涤干净。检验
操作是是。
(5)已知煅烧 的化学方程式是 ,现煅烧464.0 的 ,得到316.8 产品,若产品中杂质只有 ,则该产品中 的质量是 (摩尔质量/ ; )
 某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将
氧化成
,而稀硝酸不能氧化
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将
氧化成
,而稀硝酸不能氧化
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

 可选药品:浓硝酸、3
稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
可选药品:浓硝酸、3
稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳 已知:氢氧化钠溶液不与
反应,能与
反应
已知:氢氧化钠溶液不与
反应,能与
反应
 (1)实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
 (2)滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
(2)滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后 (3)装置①中发生反应的化学方程式是
(3)装置①中发生反应的化学方程式是 (4)装置②的作用是,发生反应的化学方程式是
(4)装置②的作用是,发生反应的化学方程式是 (5)该小组得出的结论一局的试验现象是
(5)该小组得出的结论一局的试验现象是 (6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母) a.加热该绿色溶液,观察颜色变化
a.加热该绿色溶液,观察颜色变化 b.加水稀释绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化 c.向该绿色溶液中通入氮气,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化 d.向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。 (1)现采用氢气还原法,请回答如下问题:
(1)现采用氢气还原法,请回答如下问题: ①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ; ②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号): (a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
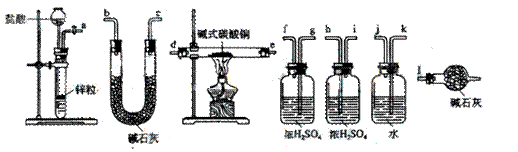 |







 ③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ; (2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。 (1)现采用氢气还原法,请回答如下问题:
(1)现采用氢气还原法,请回答如下问题: ①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ; ②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
 (a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)






 ③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ; (2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。