| A.35Cl原子所含质子数为18 |
B.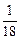 mol的H35Cl分子所含中子数约为6.02×1023 mol的H35Cl分子所含中子数约为6.02×1023 |
| C.3.5 g的35Cl2气体的体积为2.24 L |
| D.35Cl2气体的摩尔质量为70 g·mol-1 |
把a g铁铝合金粉末溶于足量盐酸中,然后加入过量NaOH溶液,过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为
| A.70% | B.52.4% | C.47.6% | D.30% |
有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液,若将甲蒸发掉一半水分,在乙中通入少量的CO2,丙不变,然后分别向甲、乙、丙三瓶中加入同浓度的盐酸,完全反应后所需盐酸溶液的体积是
| A.甲=丙>乙 | B.丙>乙>甲 | C.乙>甲=丙 | D.甲=乙=丙 |
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有
| A.AlO2— | B.Cu2+ | C.Al3+ | D.Mg2+ |
除去Na2CO3固体中少量NaHCO3的最佳方法是
| A.加入适量盐酸 | B.加入NaOH溶液 |
| C.加热 | D.配成溶液后通入CO2 |
在Na2O2与H2O的反应中,氧化剂和还原剂的质量比是
| A.1:1 | B.1:2 | C.2:1 | D.8:53 |