常温下,在0.01 mol·L-1硫酸溶液中,由水电离出的氢离子浓度是( )
| A.5×10-13 mol·L-1 | B.0.02 mol·L-1 | C.1×10-7 mol·L-1 | D.1×10-12 mol·L-1 |
在一定温度时,4 mol A在2 L的密闭容器里分解,达到平衡时,测得已有50%的A分解成B和C,A(g) 2B(g)+C(g)。此温度时,该反应的平衡常数为
2B(g)+C(g)。此温度时,该反应的平衡常数为
| A.4 | B.3 | C.2 | D.1 |
有一化学平衡mA(g)+nB(g) pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系。下列叙述正确的是
pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系。下列叙述正确的是
| A.正反应是放热反应;m+n>p+q |
| B.正反应是吸热反应;m+n<p+q |
| C.正反应是放热反应;m+n<p+q |
| D.正反应是吸热反应;m+n>p+q |
对可逆反应2A(s)+3B(g) C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动 ②升高温度,平衡向逆反应方向移动,v正减小 ③压强增大一倍,平衡不移动,v正、v逆不变 ④增大B的浓度,v正>v逆⑤加入催化剂,平衡向正反应方向移动
| A.①② | B.④ | C.③ | D.④⑤ |
在醋酸的电离过程中,加入水会使下列比值增大的是
A. |
B. |
C.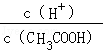 |
D. |
下列关于纯净物、混合物、电解质和非电解质的正确组合是
| 纯净物 |
混合物 |
电解质 |
非电解质 |
|
| A |
浓盐酸 |
天然气 |
硫酸 |
干冰 |
| B |
氢氧化钡 |
蔗糖溶液 |
硫酸钡 |
三氧化硫 |
| C |
胆矾 |
石灰水 |
苛性钾 |
碳酸钙 |
| D |
硫酸 |
铝合金 |
氯化钠 |
氢气 |