煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)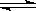 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数Kc |
9.94 |
9 |
1 |
试回答下列问题
(1)上述正向反应是: ▲ 反应(选填:放热、吸热)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 ▲ (选填A、B、C、D、E)。
| |
A |
B |
C |
D |
E |
| n(CO2) |
3 |
1 |
0 |
1 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
2 |
1 |
(3)已知在一定温度下:C(s)+CO2(g) 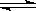 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) 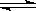 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g)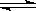 H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是: ▲ 。
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol/L,在该条件下,CO的最大转化率为: ▲ 。
(5)若在800℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y= ▲ 。
(6)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K= ▲ 。
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:
2Mn2++5S2O82-+8H2O  2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态锰原子的价电子排布式为 。
(2)上述反应涉及的元素属于同主族元素,其第一电离能由大到小的顺序为 (填元素符号)。
(3)已知H2S2O8的结构如图。
①H2S2O8硫原子的轨道杂化方式为 。
②上述反应中被还原的元素为 。
③上述反应每生成1 mol MnO4-,S2O82- 断裂的共价键类型及其数目为 、 。
(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。

①右图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为 ;
②实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是 。
(5)MnO2可用于碱锰电池材料的正极材料,加入某种纳米粉体可以优化碱锰电池的性能,该纳米粉体的结构如右图。该纳米粉体的化学式为__________。
(6)铑(Rh)与钴属于同族元素,性质相似。铑的某配合物的化学式为CsRh(SO4)2·4H2O,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,该盐溶于水的电离方程式为 。
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)氧元素能形成繁多的氧化物,请写出一个与CO2等电子的化合物_________________;
(2)把Na2O、SiO2、P2O5三种氧化物按熔沸点由高到低顺序排列_________________;
(3)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为_________________;
(4)Se原子基态核外电子的排布式为_________________;
(5)SO32-离子中硫原子的杂化方式__________,该离子的立体构型为____________;
(6)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。X与Y所形成化合物晶体的晶胞如图所示。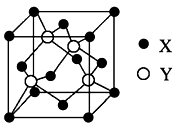
①在一个晶胞中,X离子的数目______,该化合物的化学式为______________;
②Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 ;
③Y与Z可形成YZ42-。YZ42-的空间构型为_________(用文字描述);写出一种与YZ42-互为等电子体的分子的化学式____________;
④X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为________;
I(1)在MgCl2溶液中滴加少量NaOH溶液,现象为______________,继续加入过量的NaOH溶液,现象为________________。
(2)在AlCl3溶液中滴加少量NaOH溶液,现象为_________________,所发生反应的离子方程式为________________________,继续加入过量的NaOH溶液,现象为___________,所发生反应的离子方程式为___________。
II将下列现象或用途中硫酸所表现出来的性质填写在空白处。
(1)把锌粒放入稀硫酸中时,有气体放出,_____________________。
(2)浓硫酸能够用于干燥某些气体,___________________________。
(3)用玻璃棒蘸浓硫酸滴在纸上时,纸变黑,_______________________。
(4)把木炭放入热的浓硫酸中时,有气体放出,_____________________。
III漂白液、漂白粉和漂粉精既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池及环境的消毒剂。
(1)在常温下,将氯气通入NaOH溶液中制取漂白液的化学方程式为:____________。
(2)漂白粉或漂粉精的有效成分是___________,使用漂白粉或漂粉精时通常要加入少量的水并通入CO2,此操作方法的目的是:_____________________________。
I将一小块钠投入CuSO4溶液中,观察到的现象是____________(填序号)。
①钠浮于液面上;②熔化成小球;③发出嘶嘶的响声,放出气体;④有蓝色沉淀产生;⑤析出大量红色的铜;⑥小球在溶液中沉浮;⑦小球在液面上游动、逐渐变小,直至消失。请用离子方程式解释实验现象_______________________ __。
II完成下列反应的化学方程式或离子方程式:
(1)铁粉与水蒸气反应化学方程式:______________________________________。
(2)铝与氢氧化钠溶液反应化学方程式:_______________ _________________。
(3)锌粒与氯化铜溶液反应离子方程式:__________________ ______________。
根据下面的反应路线及所给信息填空。
(1)A的结构简式是_____________,名称是_____________。
(2)②的反应类型_____________,③的反应类型_____________。
(3)反应④的化学方程式 。