(10分)将一定量的晶体A,隔绝空气加热到200OC时,全部分解为B、C、D、E四种气体,且其物质的量之比为2:1:l:1。这四种气体物质与其它物质的相互转化关系如下图所示。J是一种常见金属单质,C在固体时可用于人工降雨,D常温下是一种无色液体,F是一种可助燃的气体单质,固体K是具有磁性的黑色晶体。图中部分反应条件及生成物没有列出: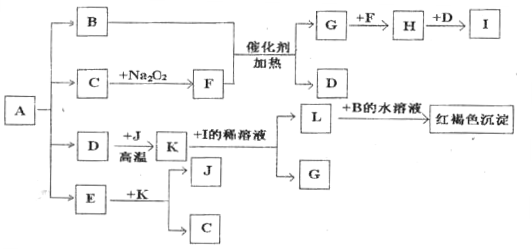
请按要求填空:
(1)C的分子式为 。
(2)写出L和B的水溶液反应的离子方程式 。
(3)写出K和盐酸溶液反应的离子方程式 。
1molK溶于足量I的稀溶液时,转移的电子数目为 。
(4)写出D与J反应的化学方程式 。
(5)A的化学式为 。
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)
和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随
c(H+)的增大而增强,有关方程式为:
ClO3-+3 HSO3-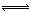 Cl-+3 H+ +3 SO42-
Cl-+3 H+ +3 SO42-
(1)反应开始时反应速率加快的原因是
(2)反应后期反应速率下降的原因是

如图所示,已知G 、A分别是海水中含量最多的两种化合物,E是“84”消毒液的主要成分具有漂白性,请回答以下问题
(1)分别写出A、C、D、F、E的电子式:A 、C 、
D 、F 、E
(2)电解G 、A的混合物阴极上的电 极反应式为
极反应式为
若同时在两电极附近各滴入几滴酚酞试液,阴极附近观察到的现象是 ;
阳极上的电极反应式为 ,检验该电极反应产物的方法是 。
(3)C和D反应可以生成一种强酸盐和生成一种弱酸盐写出方程式
该弱酸盐具有 性,常用于杀菌消毒。
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答: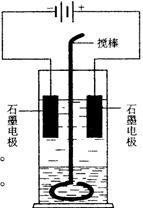
(1)阳极上的电极反应式为________________________________。
(2)阴极上的电极反应式为_____________________ ___________。
___________。
(3)原上层液体是________________________________________。
(4)原下层液体是________________________________________。
(5)搅拌后两层液体颜色发生变化的原因是__________________。
从H+、Cu2+、Na+、SO42-、Cl-等五种离子中选择适当的离子组成电解质,使之符合下列要求。
(1)以碳棒为电极,电解时电解质质量减小,水量不变,应选用的电解质是________________
(2)以碳棒为电极,电解时电解质质量不变,水量减少,应选用的电解质是_______________;
(3)以碳棒为阳极,铁棒为阴极,电解时电解质质量和水量都减少,则应选用的电解质是_____________________________。
铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断
(1)蓄电池的负极是______,其电极反应式为______。
(2)蓄电池的正极是______,其电极反应式为______。
(3)蓄电池工作时,其中电解质溶液的pH______(增大、减小、不变)。 (4)实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是
(4)实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是